题目内容
 某实验小组模拟工业合成氨,利用合成的氨气验证氨气具有还原性实验.
某实验小组模拟工业合成氨,利用合成的氨气验证氨气具有还原性实验.Ⅰ.利用反应N2+3H2
| 催化剂 |
| 高温、高压 |
| P |
| P0 |
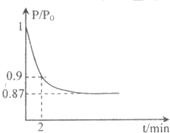
(1)2min时,以c(NH3)变化表示的平均反应速率为
(2)若提高H2的转化率可采取的措施有
A.向体系中再充入一定量的H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2
(3)反应达到平衡的标志
A.反应体系压强不再变化 B.反应体系密度不再变化
C.氨气的生成速率是氮气消耗速率的二倍 D.反应停止的状态
Ⅱ.氨气与氧化铜反应,黑色固体变成光亮的红色.有资料显示,Cu2O也是红色固体,不溶于水,溶于稀硫酸,生成生成Cu和CuSO4.溶于盐酸生成白色氯化亚铜结晶粉末.
(1)提出假设:1.红色固体为Cu 2.
(2)写出Cu2O与稀硫酸反应的离子方程式
(3)设计方案,验证以上假设,写出实验步骤和现象以及结论.
| 实验步骤 | 现象和结论 |
考点:化学平衡的影响因素,化学平衡建立的过程,化学平衡状态的判断,铜金属及其重要化合物的主要性质
专题:化学平衡专题,元素及其化合物
分析:Ⅰ、(1)依据化学反应速率=
计算;
(2)依据化学平衡移动原理分析,提高H2的转化率,就是使反应向正向进行,尽可能多得消耗H2;
(3)反应前后,气体体积不相等,压强不变说明达到平衡,混合气体密度始终不变,不能说明是否达到平衡,氨气的生成速率始终是氮气消耗速率的二倍,也不能说明是否达到平衡,化学平衡是动态平衡,虽然达到平衡,但反应仍在进行,并没有停止;
Ⅱ、(1)依据题干假设分析;
(2)氧化亚铜与稀硫酸反应,生成铜和硫酸铜,依据元素化合价变化分析判断,氧化剂是盐酸化合价降低的物质;
(3)根据提给信息,在混合固体中加入稀硫酸,再根据剩余固体的质量就可以确定固体成分.
| △c |
| △t |
(2)依据化学平衡移动原理分析,提高H2的转化率,就是使反应向正向进行,尽可能多得消耗H2;
(3)反应前后,气体体积不相等,压强不变说明达到平衡,混合气体密度始终不变,不能说明是否达到平衡,氨气的生成速率始终是氮气消耗速率的二倍,也不能说明是否达到平衡,化学平衡是动态平衡,虽然达到平衡,但反应仍在进行,并没有停止;
Ⅱ、(1)依据题干假设分析;
(2)氧化亚铜与稀硫酸反应,生成铜和硫酸铜,依据元素化合价变化分析判断,氧化剂是盐酸化合价降低的物质;
(3)根据提给信息,在混合固体中加入稀硫酸,再根据剩余固体的质量就可以确定固体成分.
解答:
解:Ⅰ.(1)2min时,混合气体减少了1mol,则反应的N2为0.5mol,生成NH31mol,用c(NH3)变化表示的平均反应速率=
=0.25mol/(L?min);
故答案为:0.25mol/(L?min);
(2)提高H2的转化率,就是使反应向正向进行,尽可能多得消耗H2,
A、虽然平衡正向移动,但消耗的H2少,加入的H2多,H2转化率减小,故A错误;
B、分离出NH3,平衡正向移动,H2转化率增大,故B正确;
C、升高温度,平衡逆向进行,H2转化率减小,故C错误;
D、充入He气使压强增大,分压不变,各物质的浓度不变,平衡不移动,H2转化率不变,故D错误;
E、加入一定量N2,平衡正向移动,H2转化率增大,故E正确;
故选BE.
(3)A、反应前后,气体体积不相等,压强不变说明达到平衡,故A正确;
B、气体质量不变,体积不变,混合气体密度始终不变,不能说明是否达到平衡,故B错误;
C、氨气的生成速率始终是氮气消耗速率的二倍,是正反应方向进行,不能说明是否达到平衡,故C错误;
D、化学平衡是动态平衡,虽然达到平衡,但反应仍在进行,并没有停止,故D错误;
故选A.
Ⅱ.(1)根据题给条件,1.红色固体为Cu,3.红色固体为Cu2O和Cu,假设2应给是红色固体为Cu2O;
故答案为:红色固体为Cu2O;
(2)根据题给条件,氧化亚铜与稀硫酸反应,生成铜和硫酸铜,反应离子方程式为:Cu2O+2H+=Cu2++Cu+H2O,反应中铜元素化合价+1价变化为0价和+2价,化合价降低做氧化剂,化合价+1价变化为+2价,化合价升高做还原剂,所以氧化亚铜既是氧化剂又是还原剂;
故答案为:Cu2O+2H+=Cu2++Cu+H2O,Cu2O;
(3)根据提给信息,在混合固体中加入稀硫酸,再根据剩余固体的质量就可以确定固体成分.
假设ag红色固体中只含有氧化亚铜,设氧化亚铜和稀硫酸反应生成铜的质量为X,
Cu2O+H2SO4═CuSO4+Cu+H2O
144 64
ag X
X=0.444ag.
故答案为:
| ||
| 2min |
故答案为:0.25mol/(L?min);
(2)提高H2的转化率,就是使反应向正向进行,尽可能多得消耗H2,
A、虽然平衡正向移动,但消耗的H2少,加入的H2多,H2转化率减小,故A错误;
B、分离出NH3,平衡正向移动,H2转化率增大,故B正确;
C、升高温度,平衡逆向进行,H2转化率减小,故C错误;
D、充入He气使压强增大,分压不变,各物质的浓度不变,平衡不移动,H2转化率不变,故D错误;
E、加入一定量N2,平衡正向移动,H2转化率增大,故E正确;
故选BE.
(3)A、反应前后,气体体积不相等,压强不变说明达到平衡,故A正确;
B、气体质量不变,体积不变,混合气体密度始终不变,不能说明是否达到平衡,故B错误;
C、氨气的生成速率始终是氮气消耗速率的二倍,是正反应方向进行,不能说明是否达到平衡,故C错误;
D、化学平衡是动态平衡,虽然达到平衡,但反应仍在进行,并没有停止,故D错误;
故选A.
Ⅱ.(1)根据题给条件,1.红色固体为Cu,3.红色固体为Cu2O和Cu,假设2应给是红色固体为Cu2O;
故答案为:红色固体为Cu2O;
(2)根据题给条件,氧化亚铜与稀硫酸反应,生成铜和硫酸铜,反应离子方程式为:Cu2O+2H+=Cu2++Cu+H2O,反应中铜元素化合价+1价变化为0价和+2价,化合价降低做氧化剂,化合价+1价变化为+2价,化合价升高做还原剂,所以氧化亚铜既是氧化剂又是还原剂;
故答案为:Cu2O+2H+=Cu2++Cu+H2O,Cu2O;
(3)根据提给信息,在混合固体中加入稀硫酸,再根据剩余固体的质量就可以确定固体成分.
假设ag红色固体中只含有氧化亚铜,设氧化亚铜和稀硫酸反应生成铜的质量为X,
Cu2O+H2SO4═CuSO4+Cu+H2O
144 64
ag X
X=0.444ag.
| 实验步骤 | 现象和结论 |
| 取一定质量(ag)的红色固体,加入稀硫酸,反应完毕,洗涤、干燥、称量固体 | ①若固体质量无变化,仍为红色,则只有Cu ②若剩余固体质量为0.444ag,则只有Cu2O ③若剩余固体质量大于0.444ag,则有Cu2O和Cu |
| 实验步骤 | 现象和结论 |
| 取一定质量(ag)的红色固体,加入稀硫酸,反应完毕,洗涤、干燥、称量固体 | ①若固体质量无变化,仍为红色,则只有Cu ②若剩余固体质量为0.444ag,则只有Cu2O ③若剩余固体质量大于0.444ag,则有Cu2O和Cu |
点评:本题考查了化学平衡图象分析,化学平衡计算应用,物质组成的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.下列叙述正确的是( )
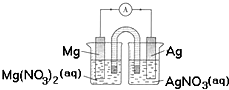

| A、银片为负极,发生的反应为:Ag++e-=Ag |
| B、进行实验时,琼脂中K+移向Mg(NO3)2溶液 |
| C、用稀硫酸代替AgNO3溶液,可形成原电池 |
| D、取出盐桥,电流表依然有偏转 |
下列物质在常温下体积受压强影响最大的是( )
| A、水 | B、空气 | C、NaCl | D、酒精 |
 能源的开发利用与人类社会的可持续发展息息相关.
能源的开发利用与人类社会的可持续发展息息相关.
 已知X(g)+Y(g)?2Z(g)+W(g)△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入1molX和1molY,在500℃时充分反应,达平衡后Z的浓度为w mol/L,放出热量Q2kJ.
已知X(g)+Y(g)?2Z(g)+W(g)△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入1molX和1molY,在500℃时充分反应,达平衡后Z的浓度为w mol/L,放出热量Q2kJ.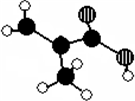 某化工厂生产的某产品只含C、H、O三种元素,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂生产的某产品只含C、H、O三种元素,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等).