题目内容
【题目】对于放热反应H2 + Cl2 ![]() 2HCl下列说法中正确的是
2HCl下列说法中正确的是
A. 该反应中,化学能只转变为热能
B. 反应物所具有的总能量高于产物所具有的总能量
C. 产物所具有的总能量高于反应物所具有的总能量
D. 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成2mol H-Cl键所放出的能量
【答案】BD
【解析】A、在该反应中,化学能不仅转变为热能,还有光能等,故A错误;B、放热反应就是反应物所具有的总能量高于生成物所具有的总能量,所以B正确;C、产物所具有的总能量高于反应物所具有的总能量,则为吸热反应,故C错误;D、从键能的角度分析,放热反应就是反应物化学键断裂所吸收的总能量小于生成物化学键形成所放出的总能量,故D正确。本题正确答案为BD。

 阅读快车系列答案
阅读快车系列答案【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。

供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,.向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeCl2 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)________________________造成的,请设计实验证明他们的猜想是否正确________________________________________________。
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(2)W的最简单氢化物的电子式为________________。
(3)W、X简单氢化物中沸点较高的是___________(填化学式)。
(4)Y单质与Fe2O3反应能放出大量的热,常用于焊接钢轨,该反应化学方程式为________。
(5)向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为_________。
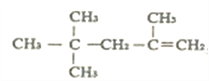
(6)分子式为C4H9Z的有机物其同分异构体有_____种。