题目内容
已知在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为4:2:1,现加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为1:3:9,则投入的铁粉与原溶液中Cu2+的物质的量之比为
- A.3:5
- B.5:6
- C.5:4
- D.2:3
B
试题分析:因为铁粉先与Fe3+反应,再与Cu2+反应,反应后的溶液中还有Fe3+,说明铁粉没有与Cu2+反应,只发生一个反应Fe+2FeCl3=3FeCl2,设铜离子为x mol,则反应前的Fe3+、Fe2+为2x mol、x/2mol,反应后的Fe3+、Fe2+为x/3 mol、3x mol,则加入的铁粉为5x/6 mol,故选B。
考点:考查铁三角的转化及化学计算。
点评:本题中要考虑Fe3+、Cu2+、Fe2+氧化性强弱顺序。属于中等题。
试题分析:因为铁粉先与Fe3+反应,再与Cu2+反应,反应后的溶液中还有Fe3+,说明铁粉没有与Cu2+反应,只发生一个反应Fe+2FeCl3=3FeCl2,设铜离子为x mol,则反应前的Fe3+、Fe2+为2x mol、x/2mol,反应后的Fe3+、Fe2+为x/3 mol、3x mol,则加入的铁粉为5x/6 mol,故选B。
考点:考查铁三角的转化及化学计算。
点评:本题中要考虑Fe3+、Cu2+、Fe2+氧化性强弱顺序。属于中等题。

练习册系列答案
相关题目

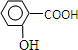
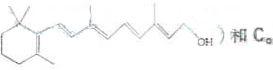 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.




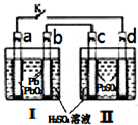 飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为:
飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为: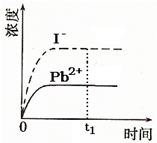 ④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图.
④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图. (其中I、Ⅱ为未知部分的结构)
(其中I、Ⅱ为未知部分的结构)



