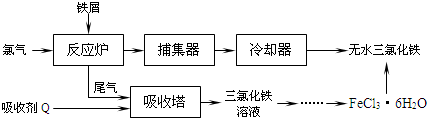
题目内容
已知某FeCl3样品中含有少量FeCl2杂质,某实验小组要测定其中铁元素的质量分数,进行了一系列实验,其操作步骤如图所示:
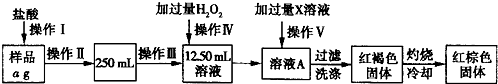
根据如图所示流程示意图,请回答下列问题:
(1)操作Ⅰ中,在溶解样品时,滴加盐酸的作用是
(2)操作Ⅱ中,所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有
a.50mL烧杯
b.50mL量筒
c.25.00mL滴定管
(3)操作ⅠV中加入过量H2O2,将Fe2+完全氧化为Fe3+,完成并配平该离子方程式:
(4)检验沉淀是否已经洗涤干净的操作步骤是
(5)在最后一步操作中,将沉淀物转移到
(6)若坩埚的质量是W1g,坩埚与加热后固体的总质量是W2g,则样品中铁元素的质量分数是
×100%
×100%(列出原始计算式);若称量准确,最终测量的结果偏大,则造成误差的原因可能是

根据如图所示流程示意图,请回答下列问题:
(1)操作Ⅰ中,在溶解样品时,滴加盐酸的作用是
增强溶液的酸性,抑制Fe3+水解
增强溶液的酸性,抑制Fe3+水解
.(2)操作Ⅱ中,所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有
250mL容量瓶
250mL容量瓶
(填仪器名称),操作Ⅲ必须用到的仪器是c
c
(填编号).a.50mL烧杯
b.50mL量筒
c.25.00mL滴定管
(3)操作ⅠV中加入过量H2O2,将Fe2+完全氧化为Fe3+,完成并配平该离子方程式:
2
2
Fe2++1
1
H2O2+2
2
H+
H+
=2
2
Fe3++2
2
H2O.(4)检验沉淀是否已经洗涤干净的操作步骤是
取少量最后一次洗出液,滴加硝酸,再滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净
取少量最后一次洗出液,滴加硝酸,再滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净
.(5)在最后一步操作中,将沉淀物转移到
坩埚
坩埚
(填仪器名称)中灼烧、冷却后,用天平称量红棕色固体的质量为m1g,再次重复操作,称量其质量为m2g,若m1-m2=0.3,则接下来还应进行的操作是应再次灼烧、冷却称量,直至两次质量差小于0.1g
应再次灼烧、冷却称量,直至两次质量差小于0.1g
.(6)若坩埚的质量是W1g,坩埚与加热后固体的总质量是W2g,则样品中铁元素的质量分数是
| 14(w2-w1) |
| a |
| 14(w2-w1) |
| a |
固体加热时未充分反应变为Fe2O3
固体加热时未充分反应变为Fe2O3
(写出一种原因即可).分析:(1)由于Fe3+易水解,为防止Fe3+水解,一般配制氯化铁溶液需要加入盐酸;
(2)操作Ⅱ中是用固体配制成250mL溶液氯化铁溶液,配制溶液需要用到的仪器有:天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管等;
操作Ⅲ中量取12.50mL溶液,依据精确度,只能选择滴定管;
(3)根据化合价升降配平发生氧化还原反应的物质的系数,再根据电荷守恒、原子守恒确定缺项物质并配平其它物质的系数;
(4)检验沉淀是否洗涤干净,即检验沉淀表面是否存在溶液中的一些离子,即检验沉淀表面是否附着氯离子;
(5)移至坩埚中加热,根据两次质量差是否小于0.1g判断加热反应是否完全,若大于0.1g,应再次灼烧、冷却称量,直至两次质量差小于0.1g;
(6)氢氧化铁加热灼烧后生成氧化铁,坩埚质量是W1,坩埚与加热后固体总质量是W2,则氧化铁的质量为(W2-W1)g.氧化铁中铁元素的质量等于样品中铁元素的质量,进而计算铁元素的质量分数;
根据Fe元素质量分数表达式,判断测量的结果偏大可能原因.
(2)操作Ⅱ中是用固体配制成250mL溶液氯化铁溶液,配制溶液需要用到的仪器有:天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管等;
操作Ⅲ中量取12.50mL溶液,依据精确度,只能选择滴定管;
(3)根据化合价升降配平发生氧化还原反应的物质的系数,再根据电荷守恒、原子守恒确定缺项物质并配平其它物质的系数;
(4)检验沉淀是否洗涤干净,即检验沉淀表面是否存在溶液中的一些离子,即检验沉淀表面是否附着氯离子;
(5)移至坩埚中加热,根据两次质量差是否小于0.1g判断加热反应是否完全,若大于0.1g,应再次灼烧、冷却称量,直至两次质量差小于0.1g;
(6)氢氧化铁加热灼烧后生成氧化铁,坩埚质量是W1,坩埚与加热后固体总质量是W2,则氧化铁的质量为(W2-W1)g.氧化铁中铁元素的质量等于样品中铁元素的质量,进而计算铁元素的质量分数;
根据Fe元素质量分数表达式,判断测量的结果偏大可能原因.
解答:解:(1)由于Fe3+易水解,为防止Fe3+水解,一般配制氯化铁溶液需要加入盐酸,增强溶液的酸性,抑制Fe3+水解,
故答案为:增强溶液的酸性,抑制Fe3+水解;
(2)操作Ⅱ中是用固体配制成250mL溶液氯化铁溶液,配制溶液需要用到的仪器有:天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管等,还需要250mL容量瓶;
操作Ⅲ中量取12.50mL溶液,依据精确度,只能选择滴定管,
故答案为:250mL容量瓶;c;
(3)反应中Fe2+→Fe3+,Fe元素化合价升高1价,共升高1价,H2O2→H2O,O元素化合价由-1价降低为-2价,共降低2价,化合价升降最小公倍数为1,故Fe2+的系数为2、H2O2的系数为1,根据原子守恒可知H2O的系数为1、Fe3+的系数为2,由电荷守恒与H原子守恒可知,缺项为H+,其系数为2,配平后方程式为:2Fe2++1H2O2+2H+=2Fe3++2H2O,
故答案为:2、1、2H+、2、2;
(4)检验沉淀是否洗涤干净,即检验沉淀表面是否存在溶液中的一些离子,即检验沉淀表面是否附着氯离子,具体操作为:取少量最后一次洗出液,滴加硝酸,再滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净,
故答案为:取少量最后一次洗出液,滴加硝酸,再滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
(5)移至坩埚中加热,根据两次质量差是否小于0.1g判断加热反应是否完全,若m1-m2=0.3>0.1g,应再次灼烧、冷却称量,直至两次质量差小于0.1g,
故答案为:应再次灼烧、冷却称量,直至两次质量差小于0.1g;
(6)氢氧化铁加热灼烧后生成氧化铁,坩埚质量是W1,坩埚与加热后固体总质量是W2,则氧化铁的质量为(W2-W1)g,氧化铁中铁元素的质量为(W2-W1)g×
=
g,故样品中铁元素的质量=
g×g,样品中铁元素的质量分数为
×100%=
×100%;
固体加热时未充分反应变为Fe2O3,导致W2偏大,测量误差偏大,
故答案为:
×100%;固体加热时未充分反应变为Fe2O3.
故答案为:增强溶液的酸性,抑制Fe3+水解;
(2)操作Ⅱ中是用固体配制成250mL溶液氯化铁溶液,配制溶液需要用到的仪器有:天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管等,还需要250mL容量瓶;
操作Ⅲ中量取12.50mL溶液,依据精确度,只能选择滴定管,
故答案为:250mL容量瓶;c;
(3)反应中Fe2+→Fe3+,Fe元素化合价升高1价,共升高1价,H2O2→H2O,O元素化合价由-1价降低为-2价,共降低2价,化合价升降最小公倍数为1,故Fe2+的系数为2、H2O2的系数为1,根据原子守恒可知H2O的系数为1、Fe3+的系数为2,由电荷守恒与H原子守恒可知,缺项为H+,其系数为2,配平后方程式为:2Fe2++1H2O2+2H+=2Fe3++2H2O,
故答案为:2、1、2H+、2、2;
(4)检验沉淀是否洗涤干净,即检验沉淀表面是否存在溶液中的一些离子,即检验沉淀表面是否附着氯离子,具体操作为:取少量最后一次洗出液,滴加硝酸,再滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净,
故答案为:取少量最后一次洗出液,滴加硝酸,再滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
(5)移至坩埚中加热,根据两次质量差是否小于0.1g判断加热反应是否完全,若m1-m2=0.3>0.1g,应再次灼烧、冷却称量,直至两次质量差小于0.1g,
故答案为:应再次灼烧、冷却称量,直至两次质量差小于0.1g;
(6)氢氧化铁加热灼烧后生成氧化铁,坩埚质量是W1,坩埚与加热后固体总质量是W2,则氧化铁的质量为(W2-W1)g,氧化铁中铁元素的质量为(W2-W1)g×
| 112 |
| 160 |
| 112(w2-w1) |
| 160 |
| 112(w2-w1) |
| 160 |
| ||||
| ag |
| 14(w2-w1) |
| a |
固体加热时未充分反应变为Fe2O3,导致W2偏大,测量误差偏大,
故答案为:
| 14(w2-w1) |
| a |
点评:考查学生溶液的配制、对实验原理理解、对实验操作的评价、物质含量的测定、氧化还原反应、化学计算等,难度较大,是对所学知识的综合运用,需要学生具备扎实的基础知识与分析问题、解决问题能力.

练习册系列答案
相关题目