题目内容
5.X、Y、Z、W是短周期元素,原子序数依次增大.X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子、W元素的+3价阳离子的核外电子排布均与氖原子相同.下列说法正确的是( )| A. | X、Y形成的具有10e-的分子中含非极性共价键 | |
| B. | X单质和Z单质在暗处剧烈反应形成的化合物比HCl稳定 | |
| C. | 含W元素的盐溶液一定显酸性 | |
| D. | Z离子半径小于W离子半径 |
分析 X、Y、Z、W是短周期元素,原子序数依次增大.X是原子半径最小的元素,X为H;Z元素的-1价阴离子、W元素的+3价阳离子的核外电子排布均与氖原子相同,均为10电子微粒,则Z为F,W为Al.结合原子序数及Y元素原子的最外层电子数是电子层数的2倍,Y为第二周期元素,最外层电子数为4,则Y为C元素,以此来解答.
解答 解:由上述分析可知,X为H,Y为C,Z为F,W为Al,
A.X、Y形成的具有10e-的分子为甲烷,只含C-H极性键,故A错误;
B.F的非金属性最强,则X单质和Z单质在暗处剧烈反应形成的化合物比HCl稳定,故B正确;
C.含W元素的盐溶液,为氯化铝时水解显酸性,为偏铝酸钠时水解显碱性,故C错误;
D.具有相同电子排布的离子中,原子序数大的离子半径小,则Z离子半径大于W离子半径,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
15.下列化合物中既有离子键又有共价键的是( )
| A. | SiO2 | B. | CO2 | C. | NaBr | D. | NH4Cl |
16.如图是SO2(g)和O2(g)的能量变化示意图,由图可知( )


| A. | 2SO2(g)+O2 (g)?2SO3 (g)-197.8kJ | B. | 2SO2 (g)+O2 (g)?2SO3 (g)+197.8kJ | ||
| C. | 2SO2 (g)+O2 (g)?2SO3 (g)+98.9kJ | D. | 2SO2 (g)+O2 (g)?2SO3 (g)-98.9kJ |
13.下列说法中正确的是( )
| A. | 每一周期的元素都是从碱金属开始,最后以稀有气体结束 | |
| B. | 同一周期中(除第一周期外),从左到右,各元素原子核的电子数都是从1个逐渐增加到8个 | |
| C. | 元素周期表一共有7个周期,16个族 | |
| D. | 第七周期只有23种元素 |
20.氮氧化铝(AlON)是一种高硬度防弹材料,可以在高温下由反应Al2O3+C+N2═2AlON+CO合成,下列有关说法合理的是( )
| A. | 上述反应中氮气作还原剂 | |
| B. | 氮氧化铝中氮元素的化合价是-3 | |
| C. | 氮氧化铝晶体中的作用力是范德华力 | |
| D. | 根据氮氧化铝晶体的硬度可推断其晶体类型可能与石英相同 |
10.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
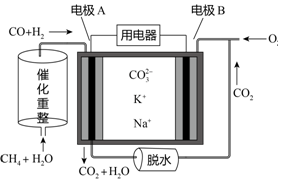

| A. | 电极A上H2和CO都发生了氧化反应 | |
| B. | 反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1molCH4转移12mol电子 | |
| C. | 电池工作时,电能转变为化学能 | |
| D. | 电极B上发生的电极反应为:O2+2H2O+4e-═4OH- |
17.下列关于原电池的叙述中错误的是( )
| A. | 原电池是将化学能转变为电能的装置 | |
| B. | 构成原电池的正极和负极必须是两种不同的金属 | |
| C. | 原电池放电时,电流的方向是从正极到负极 | |
| D. | 在原电池中,电子流出的一极是负极,发生氧化反应 |
15.关于化学反应与能量,下列说法不正确的是( )
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 化学反应一定伴随着能量变化 | |
| C. | 人体运动所消耗的能量与化学反应无关 | |
| D. | 植物的光合作用将太阳能转化为化学能 |
