题目内容
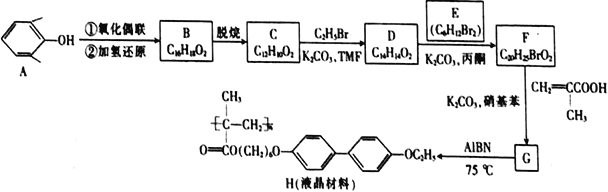
【题目】氮化镁(Mg3N2) 在工业上具有非常广泛的应用。某化学兴趣小组用镁与氮气反应制备Mg3N2并进行有关实验。实验装置如下所示:
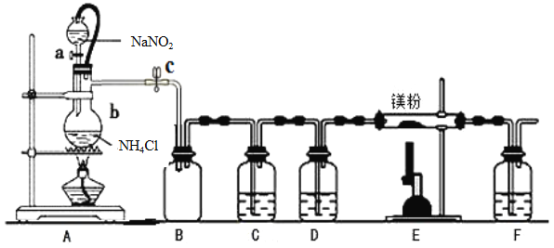
已知:①氮化镁常温下为浅黄色粉末,极易与水反应。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
回答下列问题:
(1)仪器a、b的名称分别是____________,____________;写出装置A 中发生反应的化学方程式____________。
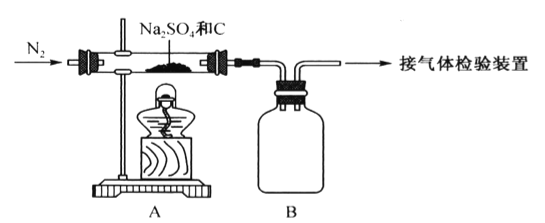
(2)装置C中为饱和硫酸亚铁溶液,作用是_________,该装置中发生反应的离子方程式为____________;装置D 中的试剂是____________,F 装置的作用是____________。
(3)加热至反应开始发生,需移走A 处酒精灯,原因是____________。
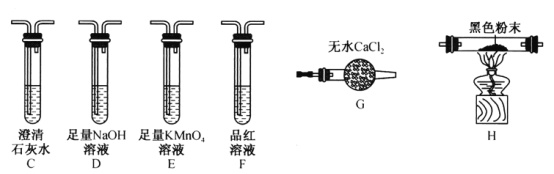
(4)实验结束后,取装置E的硬质玻璃管中的少量固体于试管中,加少量蒸馏水,把润湿的红色石蕊试纸放在管口,观察实验现象,该操作的目的是______________。反应的化学方程式为操作的目的是__________;再弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是__________。
【答案】 分液漏斗 蒸馏烧瓶 NH4Cl+NaNO2![]() N2↑+NaCl+2H2O 除去氧气 4Fe2++O2+4H+=4Fe3++2H2O 浓硫酸 防止空气中的水蒸气进入E装置使氮化镁水解 该反应剧烈放热,产生氮气的速度较快,移走A处酒精灯能避免反应物冲出;同时避免温度过高,造成NaNO2分解产生O2 证明产物中是否有Mg3N2生成 Mg3N2+6H2O=3Mg(OH)2+2NH3↑ 证明产物中是否含有未反应的镁
N2↑+NaCl+2H2O 除去氧气 4Fe2++O2+4H+=4Fe3++2H2O 浓硫酸 防止空气中的水蒸气进入E装置使氮化镁水解 该反应剧烈放热,产生氮气的速度较快,移走A处酒精灯能避免反应物冲出;同时避免温度过高,造成NaNO2分解产生O2 证明产物中是否有Mg3N2生成 Mg3N2+6H2O=3Mg(OH)2+2NH3↑ 证明产物中是否含有未反应的镁
【解析】(1). a为分液漏斗,b为蒸馏烧瓶,其瓶颈处有一略向下伸出的细玻璃管;由于反应要生成氮气,所以反应在加热条件下为NH4Cl+NaNO2![]() N2↑+NaCl+2H2O;
N2↑+NaCl+2H2O;
(2). 装置内含有氧气、反应生成的气体中可能含有氮的氧化物,对最终产物造成影响,装置C除去氧气,氧气将2价铁离子氧化为3价铁离子,离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O ;D干燥氮气,除去水蒸气,防止对E装置反应的影响,溶剂为浓硫酸;氮化镁常温下极易与水反应,F装置的作用是防止空气中的水蒸气进入E装置使氮化镁水解;
(3).由已知得:制取氮气的反应剧烈放热,产生氮气的速度较快,且温度较高时,亚硝酸钠会分解产生O2等;
(4).若产物中含有氮化镁,则固体与水反应生成氨气,润湿的红色石蕊试纸变蓝,所以此操作目的为验证产物中是否有Mg3N2生成,反应方程为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;若固体中含有未反应的镁,加入盐酸后会生成气体,所以该操作的目的是验证镁的存在。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】合成气(CO+H2) 广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气,
(1)已知标况下,5.6LCH4与水蒸气完全反应时吸收51.5kJ的热量,请写出该反应的热化学方程式________________;
(2)在150℃时2L 的密闭容器中,将2molCH4和2mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=________。
②在该温度下,计算该反应的平衡常数K=________。
③下列选项中能表示该反应已达到平衡状态的是________。
A.V(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C(CH4)=C(CO)
(3)合成气中的氢气也用于合成氨气:N2+3H2![]() 2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是_______________;
2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是_______________;
容器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2 的体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | v甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | v乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | v丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.v乙 >v>v甲 D.P乙>P甲=P丙
(4)合成气可以制取甲醚,绿色电源“二甲醚-氧气燃料电池”工作原理如下图所示
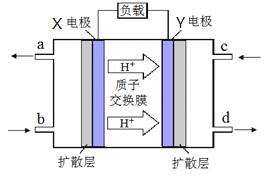
① 电极Y 上发生的反应式为__________ ;
②电池在放电过程中,电极X周围溶液的pH_______(填“增大、减小、不变”)。