题目内容
14.下列说法正确的是( )| A. | 32 g O2占有的体积约为22.4 L | |
| B. | 常温常压下,28g N2含有阿伏加德罗常数个氮气分子 | |
| C. | 在标准状况下,22.4 L水的质量约为18 g | |
| D. | 标准状况下22 g二氧化碳气体与标况下的11.2 L HCl气体含有的分子数不一样多 |
分析 A.气体存在的条件不一定为标准状况下;
B.根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算;
C.标准状况下,水为液体;
D.根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算.
解答 解:A.32 g O2为1mol,但气体存在的条件不一定为标准状况下,不一定为22.4L,故A错误;
B.n=$\frac{28g}{28g/mol}$=1mol,含有阿伏加德罗常数个氮气分子,故B正确;
C.水为液体,22.4 L水的质量约为22.4kg,故C错误;
D.标准状况下22 g二氧化碳气体的物质的量为$\frac{22g}{44g/mol}$=0.5mol,标况下的11.2 L HCl气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,含有的分子数相等,故D错误.
故选B.
点评 本题综合考查物质的量的相关计算,侧重于基本概念的理解和相关计算公式的运用,该类题目注意物质的状态与存在的条件,为易错点,但难度不大.

练习册系列答案
相关题目
4. 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓))}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制各1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此装置各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该装置各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的沸点低,过度冷却会凝固而堵塞导管.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓))}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制各1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此装置各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该装置各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的沸点低,过度冷却会凝固而堵塞导管.
5.化学与环境、材料、信息、能源关系密切,下列说法正确的是( )
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维 |
2.PbO2受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为1:1,则剩余固体的组成及物质的量比可能是( )
| A. | 1:2:1混合的PbO2、Pb3O4、PbO | B. | 1:3:2混合的PbO2、Pb3O4、PbO | ||
| C. | 1:1:1混合的PbO2、Pb3O4、PbO | D. | 2:1:1混合的PbO2、Pb3O4、PbO |
19.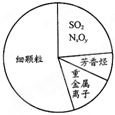 如图为雾霾的主要成分示意图.下列说法不正确的是( )
如图为雾霾的主要成分示意图.下列说法不正确的是( )
 如图为雾霾的主要成分示意图.下列说法不正确的是( )
如图为雾霾的主要成分示意图.下列说法不正确的是( )| A. | 重金属离子可导致蛋白质变性 | |
| B. | 苯是最简单的芳香烃 | |
| C. | 向空气中大量排放SO2和NxOy都能引起酸雨和光化学烟雾 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
3.不能作为判断硫、氯两种元素非金属性强弱的依据是( )
| A. | 单质氧化性的强弱 | |
| B. | 氢化物沸点的高低 | |
| C. | 氢化物还原性强弱 | |
| D. | 最高价氧化物对应的水化物酸性的强弱 |
4.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法不正确的是( )


| A. | 该硫酸的物质的量浓度为18.4 mol•L-1 | |
| B. | 该硫酸与等体积的水混合后所得溶液的质量分数大于49% | |
| C. | 配制200mL 4.6 mol•L-1的稀硫酸需取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合后所得溶液的物质的量浓度大于9.2 mol•L-1 |
 如图,A、B、C、D是中学常见的混合物分离或提纯的基本装置.实验室用四氯化碳浓缩碘水的碘,宜选用上述装置中的C(填A、B、C、D)
如图,A、B、C、D是中学常见的混合物分离或提纯的基本装置.实验室用四氯化碳浓缩碘水的碘,宜选用上述装置中的C(填A、B、C、D)