题目内容
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷
和氧气,其总反应为:2C2H6+702+8KOH=4K2C03+10H20,有关此电池的推断正确的
是( )。
| A.负极反应为:14H20+702+28e-=280H- |
| B.放电一段时间后,负极周围pH升高 |
| C.每消耗1 mol C2H6,则电路上转移的电子为14 mol |
| D.放电过程中KOH的物质的量浓度不变 |
C
解析试题分析:该装置是燃料电池,乙烷失电子发生氧化反应,应为原电池负极,负极反应式为C2H6+18OH--14e-=2CO32-+12H2O,O2得电子被还原,应为原电池正极,电极反应式为2H2O+O2+4e-=4OH-,A选项错误,选项中给出的为正极反应。B选项错误,放电一段时间后正极周围PH升高。C选项争取。D选项错误,根据放映方程式可知,PH值降低。
考点:原电池原理

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
图中两电极上发生的电极反应如下:a极:Cu2++2e-=Cu,b极:Fe-2e-=Fe2+,则以下说法不正确的是( )
| A.该装置可能是电解池 |
| B.a极上一定发生还原反应 |
| C.a、b可能是同种电极材料 |
| D.该过程中能量的转换一定是化学能转化为电能 |
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
| A.通CO的一极是电池的正极 |
| B.该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C.负极反应式为:O2+2CO2+4e-→2CO32- |
| D.正极反应式为:2CO+2CO32-→4CO2+4e- |
有关下图的说法正确的是
| A.构成原电池时溶液中SO42-移向Cu极 |
| B.构成原电池时Cu极反应为: Cu﹣2e-=Cu2+ |
| C.要使Fe极不被腐蚀,Cu片换Zn片或a接直流电源负极 |
| D.a和b分别接直流电源正、负极,Fe片上有气体产生 |
如图甲、乙是电化学实验装置。有关电极反应或计算错误的是:
| A.若甲烧杯中盛有NaCl溶液,则石墨棒上的电极反应式为O2+2H2O+4e-= 4OH- |
| B.若乙烧杯中盛有则乙中的总反应为 |
| C.若甲烧杯中盛有CuSO4溶液,则甲中铁棒上的电极反应式为Fe-2e-=Fe2+ |
| D.若起始时乙中盛有200 mL pH=5的CuSO4溶液,一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入0.6 g CuO |
一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH + 3O2 =" 2" CO2 + 3H2O,电池构造如下图。下列关于该电池的说法不正确的是
| A.放电过程中,电源内部的H+从正极区向负极区迁移 |
| B.通入乙醇的电极是负极 |
| C.该电池的正极反应为:4H+ + O2 + 4e-= 2H2O |
| D.用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L |
如图甲为锌铜原电池装置,乙为电解熔融氯化钠装置。则下列说法正确的是( )
| A.甲装置中锌为负极,发生还原反应 |
| B.甲装置盐桥的作用是使反应过程中ZnSO4溶液和CuSO4溶液保持电中性 |
| C.乙装置中铁极为阳极,电极反应式为: 2Na++2e-=2Na |
| D.乙装置中B是氯气出口,A是钠出口 |
用如图所示装置进行实验,下列叙述不正确的是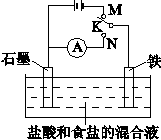
| A.K与N连接时,铁被腐蚀 |
| B.K与N连接时,石墨电极产生气泡 |
| C.K与M连接时,一段时间后溶液的pH增大 |
| D.K与M连接时,石墨电极反应:4OH- - 4e- = 2H2O + O2↑ |
