题目内容
图中两电极上发生的电极反应如下:a极:Cu2++2e-=Cu,b极:Fe-2e-=Fe2+,则以下说法不正确的是( )
| A.该装置可能是电解池 |
| B.a极上一定发生还原反应 |
| C.a、b可能是同种电极材料 |
| D.该过程中能量的转换一定是化学能转化为电能 |
D
解析试题分析:可能为电解池,a极发生还原反应,为阴极,b极发生氧化反应,为阳极,电解质可为硫酸铜溶液,故A正确。Cu2+得电子被还原,故B正确。如a、b都为铁片,电解质溶液为硫酸铜,电解可发生题中反应,故C正确。可为电解池,电能转化为化学能,故D错误。
考点:原电池和电解池

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
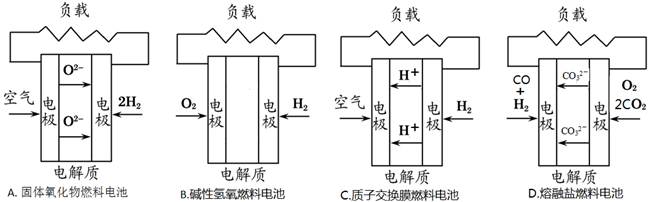
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是: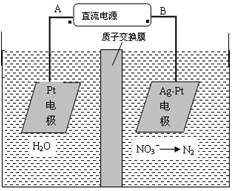
| A.A为电源正极 |
| B.阳极反应式为:2H2O-4e-=4H++O2↑ |
| C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克 |
| D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH- |
关于下列各装置图的叙述中,正确的是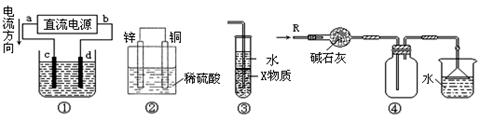
| A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应 |
| C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D.装置④可用于收集氨气,并吸收多余的氨气 |
下列关于原电池的叙述正确的是 ( )
| A.构成原电池的正极和负极必须是两种不同的金属 |
| B.原电池是将化学能转化为电能的装置 |
| C.在原电池中,电子流出的一极是负极,该电极被还原 |
| D.原电池放电时,电流的方向是从负极到正极 |
500mLKNO3和Cu(NO3) 2的混合溶液中c(NO3-) =6.0mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中c(K+) 为2 mol·L-1 |
| B.上述电解过程中共转移6mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.电解后溶液中c(H+) 为2 mol·L-1 |
如下各图烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为 ( )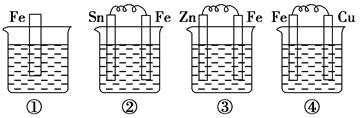
| A.②①③④ | B.④③②① |
| C.④②①③ | D.③②④① |
Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:
2Al+3 AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是 ( )
| A.当电极上析出0.54 g Ag时,电路中转移的电子为0.01 mol |
B.该隔膜是阳离子交换膜 |
| C.Al电极的反应式为:Al-3e-+3OH-=Al(OH)3 |
| D.正极的电极反应式为:AgO+2e-+2H+=Ag+H2O |
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷
和氧气,其总反应为:2C2H6+702+8KOH=4K2C03+10H20,有关此电池的推断正确的
是( )。
| A.负极反应为:14H20+702+28e-=280H- |
| B.放电一段时间后,负极周围pH升高 |
| C.每消耗1 mol C2H6,则电路上转移的电子为14 mol |
| D.放电过程中KOH的物质的量浓度不变 |