题目内容
10.足量的铁与下列酸反应,产生氢气的物质的量最多的是( )| A. | 18.4mol/L 硫酸 10mL | B. | 2mol/L 硫酸 10mL | ||
| C. | 1mol/L 硫酸 30mL | D. | 3mol/L 盐酸 10mL |
分析 足量的铁与酸反,酸中氢离子的物质的量越大,反应生成的氢气越多,其中Fe与浓硫酸发生钝化,Fe与硝酸反应生成氮的氧化物,据此分析.
解答 解:A.浓硫酸与Fe发生钝化,不生成氢气;
B.2mol/L 硫酸 10mL,其中n(H+)=2mol/L×0.01L×2=0.04mol;
C.1mol/L 硫酸 30mL,其中n(H+)=1mol/L×0.03L×2=0.06mol;
D.3mol/L 盐酸 10mL,其中n(H+)=3mol/L×0.01L×1=0.03mol;
综上可知,C中氢离子的物质的量最大,与Fe反应生成的氢气最多;
故选C.
点评 本题考查了Fe与酸的反应,题目难度不大,注意硝酸和浓硫酸的性质.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
20.下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是( )
| A. | 甲烷、辛醛 | B. | 乙醇、苯乙烯 | C. | 乙酸乙酯、甲酸 | D. | 丙炔、苯 |
18.下列反应中HNO3既表现出酸性又表现出强氧化性的是( )
| A. | 稀硝酸与CuO反应 | B. | 稀硝酸与NaOH 溶液反应 | ||
| C. | 浓硝酸与灼热的碳反应 | D. | 浓硝酸与铜反应 |
2.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)≒Y(g)+Z (s),以下能说明作为反应达到平衡标志的是( )
| A. | X的分解速率与Y的消耗速率相等 | |
| B. | X、Y与Z的物质的量之比为2:1:1 | |
| C. | 混合气体的密度不再变化 | |
| D. | 单位时间内生成lmolY的同时分解1mol X |
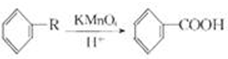 ,
,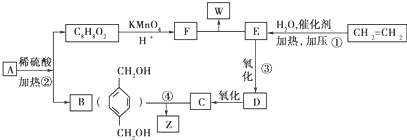
 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.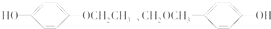 、
、 、
、 .
.