题目内容
空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注.被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等.请回答下列问题:
(1)S、N、O的第一电离能由大到小的顺序为
(2)血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒.
①写出亚铁离子的基态电子排布式
②CO有多种等电子体,其中常见的两种为
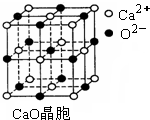
(3)SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在燃煤中加入CaO以“固硫”. CaO晶胞如图所示,其中Ca2+的配位数为
(4)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注.甲醛是室内主要空气污染物之一(其沸点是-19.5℃),甲醇是“假酒”中的主要有害物质(其沸点是64.65℃),甲醇的沸点明显高于甲醛的主要原因是:
分析:(1)同一周期,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅤA族元素大于第ⅥA族元素,同一主族,元素的第一电离能随着原子序数的增大而减小;
(2)①铁是26号元素,原子核外有26个电子,铁原子失去2个电子变成亚铁离子,亚铁离子核外有24个电子,根据构造原理写出其基态核外电子排布式;
②原子个数相等价电子数相等的微粒是等电子体;
(3)以钙离子为中心,沿X、Y、Z三轴进行切割,从而确定钙离子配位数;晶格能越大,熔点越高;
(4)利用氢键来分析物质的沸点差异.
(2)①铁是26号元素,原子核外有26个电子,铁原子失去2个电子变成亚铁离子,亚铁离子核外有24个电子,根据构造原理写出其基态核外电子排布式;
②原子个数相等价电子数相等的微粒是等电子体;
(3)以钙离子为中心,沿X、Y、Z三轴进行切割,从而确定钙离子配位数;晶格能越大,熔点越高;
(4)利用氢键来分析物质的沸点差异.
解答:解:(1)同一周期,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅤA族元素大于第ⅥA族元素,同一主族,元素的第一电离能随着原子序数的增大而减小,所以第一电离能大小顺序是:N>O>S,
故答案为:N>O>S;
(2)①铁是26号元素,原子核外有26个电子,铁原子失去2个电子变成亚铁离子,亚铁离子核外有24个电子,根据构造原理知其基态原子核外电子排布式为:1s22s22p63s23p63d6或[Ar]3d6,
故答案为:1s22s22p63s23p63d6或[Ar]3d6;
②原子个数相等价电子数相等的微粒是等电子体,CO的常见等电子体为N2、CN-,
故答案为:N2和CN-;
(3)以钙离子为中心,沿X、Y、Z三轴进行切割,结合图片知,钙离子的配位数是6;晶格能越大,熔点越高,故CaO晶体的熔点高于NaCl晶体的熔点,
故答案为:6;高于;
(4)因甲醇分子之间容易形成分子间氢键,则沸点高,而甲醛中不存在氢键,
故答案为:甲醇分子间存在氢键,而甲醛没有.
故答案为:N>O>S;
(2)①铁是26号元素,原子核外有26个电子,铁原子失去2个电子变成亚铁离子,亚铁离子核外有24个电子,根据构造原理知其基态原子核外电子排布式为:1s22s22p63s23p63d6或[Ar]3d6,
故答案为:1s22s22p63s23p63d6或[Ar]3d6;
②原子个数相等价电子数相等的微粒是等电子体,CO的常见等电子体为N2、CN-,
故答案为:N2和CN-;
(3)以钙离子为中心,沿X、Y、Z三轴进行切割,结合图片知,钙离子的配位数是6;晶格能越大,熔点越高,故CaO晶体的熔点高于NaCl晶体的熔点,
故答案为:6;高于;
(4)因甲醇分子之间容易形成分子间氢键,则沸点高,而甲醛中不存在氢键,
故答案为:甲醇分子间存在氢键,而甲醛没有.
点评:本题考查物质结构和性质,涉及第一电离能的判断、基态核外电子排布式的书写、等电子体、物质熔沸点高低判断,配位数的确定.注意同一周期中第一电离能的变化趋势及异常现象,为易错点一,易错点二是配位数的确定,要学会以一种微粒为中心,沿X、Y、Z三轴进行切割,从而确定配位数.

练习册系列答案
相关题目
