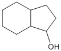
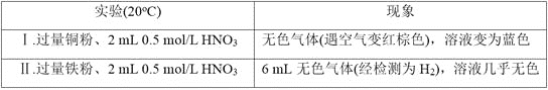
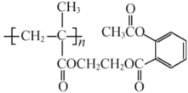
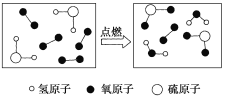
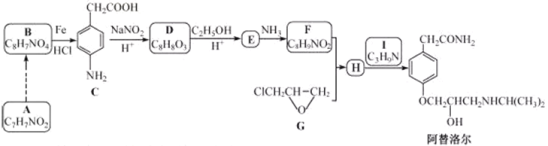
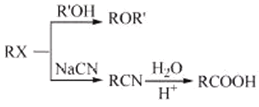
题目内容
【题目】将0.6mol KCl、0.4mol Cu(NO3)2、0.2molAgNO3一起溶于水,配成100mL混合溶液,用惰性电极电解一段时间后,若在一极析出19.2g Cu,此时在另一极上产生气体的体积(标准状况下)为
A.3.96LB.4.48LC.5.6LD.6.72L
【答案】C
【解析】
混合溶液中发生的反应为AgNO3+ KCl =AgCl↓+KNO3,得混合溶液中的溶质为0.2molKNO3、0.4molCu(NO3)2、0.4molKCl,根据Cu和转移电子之间的关系式可计算出O2和Cl2的体积。
混合溶液中发生的反应为AgNO3+ KCl =AgCl↓+KNO3,根据方程式知,0.2mol AgNO3完全反应需要0.2molKCl,还剩余0.4molKCl,且同时生成0.2molKNO3,所以混合溶液中的溶质为0.2molKNO3、0.4molCu(NO3)2、0.4molKCl,用惰性电极电解一段时间后,若在一极析出Cu:0.3mol(19.2g)<0.4mol,根据Cu和转移电子之间的关系式知,转移电子的物质的量=2n(Cu)=2×0.3mol=0.6mol,氯离子完全放电时转移电子物质的量=0.4mol×1=0.4mol,则还有0.2mol电子转移时生成氧气,则生成n(O2)=![]() =0.05mol,生成n(Cl2)=
=0.05mol,生成n(Cl2)=![]() n(Cl-)=
n(Cl-)= ![]() ×0.4mol=0.2mol,生成气体V=nVm=(0.2+0.05)mol×22.4mol/L=5.6L,
×0.4mol=0.2mol,生成气体V=nVm=(0.2+0.05)mol×22.4mol/L=5.6L,
故选C。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目