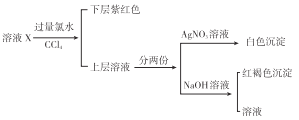
题目内容
【题目】如图是元素周期表的一部分,其中每个数字编号代表对应的一种元素.

请按要求回答下列问题:
(1)画出元素②的原子结构示意图_____________________.
(2)属于稀有气体的元素编号是________________,可作半导体材料的元素编号是_________________.
(3)③、⑦两种元素相比较,非金属性强的是__________________(填元素符号).
(4)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是__________,______.
(5)元素③和元素⑧的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式:_________________________________.
【答案】  ⑨ ⑦ N Na2O Na2O2 NH3+HCl=NH4Cl
⑨ ⑦ N Na2O Na2O2 NH3+HCl=NH4Cl
【解析】根据元素在周期表中的位置知,①~⑨分别是H、C、N、O、Na、Al、Si、Cl、Ar元素,则
(1)元素②的原子核外有2个电子层、最外层电子数是4,其原子结构示意图为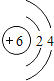 ;(2)Ar属于稀有气体,其编号是⑨;可作半导体材料的元素是Si,其编号是⑦;(3)同一周期元素,元素的非金属性随着原子序数的增大而增强,同一主族,元素的非金属性随着原子序数的增大而减弱,N元素的非金属性大于P元素,Si元素的非金属性小于P元素,所以N元素的非金属性大于Si元素;(4)元素④的单质与元素⑤的单质反应可生成两种化合物,分别为氧化钠和过氧化钠,化学式分别为:Na2O、Na2O2;(5)元素③和元素⑧的氢化物分别是氨气和氯化氢,二者均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,白烟是氯化铵固体,反应方程式为NH3+HCl=NH4Cl。
;(2)Ar属于稀有气体,其编号是⑨;可作半导体材料的元素是Si,其编号是⑦;(3)同一周期元素,元素的非金属性随着原子序数的增大而增强,同一主族,元素的非金属性随着原子序数的增大而减弱,N元素的非金属性大于P元素,Si元素的非金属性小于P元素,所以N元素的非金属性大于Si元素;(4)元素④的单质与元素⑤的单质反应可生成两种化合物,分别为氧化钠和过氧化钠,化学式分别为:Na2O、Na2O2;(5)元素③和元素⑧的氢化物分别是氨气和氯化氢,二者均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,白烟是氯化铵固体,反应方程式为NH3+HCl=NH4Cl。

【题目】(1)CH3COOH是最常见的有机弱酸。
①CH3COOH的电离方程式为_____________。
②CH3COONa溶液呈碱性,原因是__________(填“CH3COO-”或“Na+”)水解引起的。
③ 在CH3COONa溶液中,c(Na+)_______c(CH3COO-)、(填“>”“=”或“<”)
(2)已知:反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=131.3kJ/mol
CO(g)+H2(g)的△H=131.3kJ/mol
① 该反应是反应__________(填“吸热”或“放热”)。
② 若反应消耗24gC(s),则反应的热效应为__________。
(3)在一定温度下,将CO(g)和H2O(g)各0.16 mol 通入容积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t/min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
① 2 min 内,vCO=__________。
② 该温度下,此反应的平衡常数表达式K=_________。
③ 其他条件不变,再充入0.1molCO和0.1molH2O(g),达到平衡时CO 的休积分数_____(填“增大”、“减小”或“不变”)。
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极,请回答下列问题:
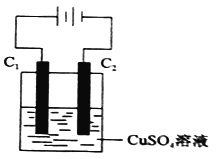
① C1作_________(填“阳极”或”阴极”)。
② C2极电极反应式为____________。