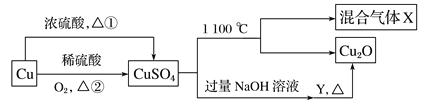
题目内容
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X的最外层电子数比内层电子数多1,Y是短周期元素中金属性最强的元素,Z的最外层电子数与次外层电子数之比为3:4。
(1)Y的原子结构示意图为_____________。
(2)W的最高价氧化物对应水化物的化学式为__________。Y和W形成的化合物的电子式为______。
(3)隔绝空气加热,Y单质可与X的氧化物反应制备X单质,该反应的化学方程式为______________
(4)0.2mol化合物Z2W2与水反应转移电子的物质的量为0.3mol,生成一种能使品红溶液褪色的气体,该反应过程中只有一种元素化合价发生变化,该反应的化学方程式为____________________。
【答案】(1)![]() ;
;
(2)HClO4;![]() (各2分)
(各2分)
(3)6Na+B2O2![]() 2B+3Na2O(2分);
2B+3Na2O(2分);
(4)2S2Cl2+2H2O=3S↓+SO2↑+4HCl(2分)。
【解析】试题分析:X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X的最外层电子数比内层电子数多1,原子只能有2个电子层,最外层电子数为3,故X为B元素;Y是短周期元素中金属性最强的元素,则Y为Na;Z的最外层电子数与次外层电子数之比为3:4,则Z为S元素,W原子序数最大,故W为Cl元素。(1)Y为Na元素,原子结构示意图为![]() ;(2)W为Cl元素,最高价氧化物对应水化物的化学式为HClO4;Y和W形成的化合物为NaCl,该物质是离子化合物,电子式为
;(2)W为Cl元素,最高价氧化物对应水化物的化学式为HClO4;Y和W形成的化合物为NaCl,该物质是离子化合物,电子式为![]() ;(3)隔绝空气加热,Na单质可与X的氧化物B2O3反应制备B单质,该反应的化学方程式为:6Na+B2O2
;(3)隔绝空气加热,Na单质可与X的氧化物B2O3反应制备B单质,该反应的化学方程式为:6Na+B2O2 ![]() 2B+3Na2O;(4)S2Cl2与水反应生成一种能使品红溶液褪色的气体为二氧化硫,只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为2S2Cl2+ 2H2O= 3S↓+SO2↑+4HCl。
2B+3Na2O;(4)S2Cl2与水反应生成一种能使品红溶液褪色的气体为二氧化硫,只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为2S2Cl2+ 2H2O= 3S↓+SO2↑+4HCl。