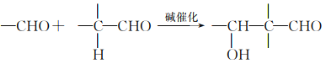��Ŀ����
����Ŀ��(һ)���ݻ�Ϊ5L���ܱ������У�ͨ��5 mol N2��8 mol H2����һ�������·�Ӧ����NH3������Ӧ���е�2 minʱ�������������4 mol NH3����
(1)2 minʱ��������n(N2)== ________ ��c(H2)== ___________ ��
(2)2 minʱ������������������ʵ����뷴Ӧǰ����������������ʵ���֮��Ϊ _______ ��
(��)A��B��C��D���ֶ�����Ԫ�أ����ǵ�ԭ������������������A��C��B��D�ֱ���ͬ����Ԫ�أ���֪B��D��Ԫ�ؼ���γ�DB2��DB3���ֻ����������Է����������16����֪A��C��Ԫ��ԭ������֮����B��D��Ԫ��ԭ������֮�͵�һ�롣��ش��������⣺
(1)д����A��B��C��Ԫ���γɵĻ�����ĵ���ʽ__________ ��
(2)��A��B��C��D����Ԫ���γɵ�����X�������ᷴӦ�ܹ����ɾ��д̼�����ζ�����壬д��X�����ᷴӦ�����ӷ���ʽ________________________��
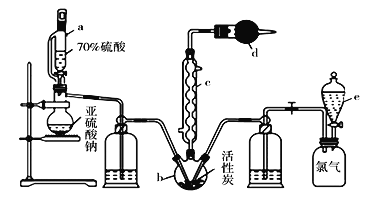
���𰸡�3 mol 0.4 mol/L 9:13 ![]() HSO3- + H+ ====SO2��+H2O
HSO3- + H+ ====SO2��+H2O
��������
(һ)��1�����ݻ�ѧ����ʽ��ʽ���㣻
��2�����ݷ�Ӧ����ʽ�����ƽ��ʱ�����ʵ������������ʵ���֮�ȣ�
(��) ��֪B��D��Ԫ�ؼ���γ�DB2��DB3���ֻ����������Է����������16�����Ƴ�B�����ԭ������Ϊ16������BΪO������ΪB��Dͬ���壬��D��ԭ����������B������DΪS��B��Dԭ������֮�͵���24��A��C��Ԫ��ԭ������֮����B��D��Ԫ��ԭ������֮�͵�һ�룬����ΪA��Cͬ���壬����AΪH��CΪNa���ݴ˷�����
(һ)��1����Ӧ�ķ���ʽΪ��
N2+3H22NH3��
��ʼ����mol�� 5 8 0
�仯����mol�� 2 6 4
ƽ������mol�� 3 2 4
��2minʱ��������n��N2��=3mol��c��H2��=![]() =0.4mol/L��
=0.4mol/L��
��2���ﵽƽ��ʱ�����ʵ����ʵ���Ϊn��N2��=3mol��n��H2��=2mol��n��NH3��=4mol��������������������ʵ����뷴Ӧǰ���������ʵ����ı�ֵΪ����3+2+4������5+8��=9��13��
(��)��֪B��D��Ԫ�ؼ���γ�DB2��DB3���ֻ����������Է����������16�����Ƴ�B�����ԭ������Ϊ16������BΪO������ΪB��Dͬ���壬��D��ԭ����������B������DΪS��B��Dԭ������֮�͵���24��A��C��Ԫ��ԭ������֮����B��D��Ԫ��ԭ������֮�͵�һ�룬����ΪA��Cͬ���壬����AΪH��CΪNa��
(1)��A��B��C��Ԫ���γɵĻ�����NaOH�ĵ���ʽΪ![]() ��
��
(2)��A��B��C��D����Ԫ���γɵ�����X�������ᷴӦ�ܹ����ɾ��д̼�����ζ������SO2����XΪNaHSO3��X�����ᷴӦ�����ӷ���ʽΪHSO3- + H+ ====SO2��+H2O��