题目内容
【题目】从宏观现象探究微观本质是重要的化学学科素养。以FeCl3溶液为实验研究对象,探究其与碱性物质之间的复杂多样性。实验如下:
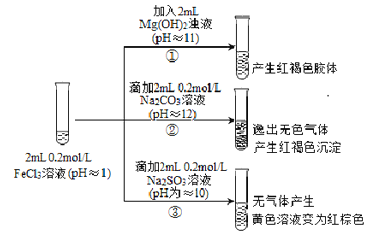
(1)①中反应的离子方程式是_________________。
(2)②中逸出的无色气体是_______________。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入少量盐酸酸化的BaCl2溶液,产生白色沉淀。 甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是______________。
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的。其实验方案是取Ⅰ中所得溶液少许进行__________离子的检验。
(4)受以上实验的启发,同学们对pH≈8的1mol/LNaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
实验操作及现象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液。溶液变无色 |
⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸馏水,溶液颜色变浅 |
Ⅰ.⑤的实验目的是___________。
Ⅱ.为探究④中溶液变无色的原因,进行如下实验:
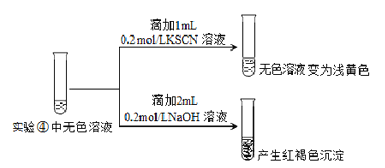
资料显示:FeF3溶液为无色。
用平衡移动原理解释红褐色沉淀产生的原因:_______________。
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与_____________________有关。
【答案】 3Mg(OH)2 +2Fe3+= 2Fe(OH)3(胶体)+ 3Mg2+ CO2 2Fe3+ + SO32- + H2O = 2Fe2+ + SO42- + 2H+ 亚铁离子(或Fe2+) 排除加水稀释对溶液颜色变化的影响 无色溶液中存在平衡:Fe3++ 3F-![]() FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3 碱性物质的pH、离子的性质
FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3 碱性物质的pH、离子的性质
【解析】(1)①中反应的离子方程式:3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+;
(2)FeCl3溶液和Na2CO3溶液反应产生无色气体CO2和红褐色沉淀氢氧化铁;
(3)Ⅰ.三价铁离子能氧化SO32-,生成硫酸根离子,同时三价铁离子被还原为亚铁离子,其反应离子方程式为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的.其实验方案是取Ⅰ中所得溶液少许进行亚铁离子(或Fe2+)的检验;
(4)Ⅰ.加水稀释对溶液颜色变化有影响;
Ⅱ.无色溶液中存在平衡:Fe3++3F-![]() FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3;
FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3;
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与碱性物质的pH、离子的性质有关。

【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
序号 | 反应温度/℃ | C(H2O2)/mol-L | V(H2O2)/mL | M(MnO2)/g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究_______对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验_____和实验____作对比(填序号)。
(3)将实验1和实验2作对比,t1____t2(填“>”、“<”或“=”)。
II.以KI和FeCl3反应为例(2Fe3++2I-![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
实验步骤:
(1)取5mL0.1mol·L-1KI溶液,再滴加几滴0.1mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂_______(填序号),现象___________,说明此反应存在一定的限度。