题目内容
【题目】常温下,0.1 mol/L 的HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是( )
A.0.01 mol/L的HA溶液中c(H+)=1×10-4 mol/L
B.pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1mol/L 的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则:c(OH-)-c(H+)<c(HA)-c(A-)
D.pH=3的HA溶液与pH=11的NaOH溶液按体积比1:10混合后所得溶液中:c(OH-)+c(A-)=c(H+)+c(Na+)
【答案】D
【解析】
试题分析:A、溶液中c(OH-)/c(H+)=1×10-8,Kw=c(H+)c(OH-)=1×10-14,两式中的氢离子浓度是溶液中酸电离出的,氢氧根离子浓度是水电离出的,联立解得c(H+)=0.001mol/L,故A错误;B、相同体积的PH=3的HA溶液与PH=11的NaOH溶液中HA的物质的量比NaOH多,混合后溶液显酸性,离子浓度大小顺序应为c(A-)>c(Na+)>c(H+)>c(OH-),故B错误;C、浓度均为0.1 molL-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,说明HA的电离程度大于酸根离子水解程度,溶液中存在电荷守恒c(OH-)+c(A-)=c(H+)+c(Na+),存在物料守恒2c(Na+)=c(HA)+c(A-),c(OH-)-c(H+)=c(Na+)-c(A-)=![]() -c(A-)=
-c(A-)=![]() >c(HA)-c(A-),c(HA)-c(A-)为负值,故C错误;D、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(OH-)+c(A-)=c(H+)+c(Na+),故D正确;故选D。
>c(HA)-c(A-),c(HA)-c(A-)为负值,故C错误;D、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(OH-)+c(A-)=c(H+)+c(Na+),故D正确;故选D。

 名校课堂系列答案
名校课堂系列答案【题目】从宏观现象探究微观本质是重要的化学学科素养。以FeCl3溶液为实验研究对象,探究其与碱性物质之间的复杂多样性。实验如下:
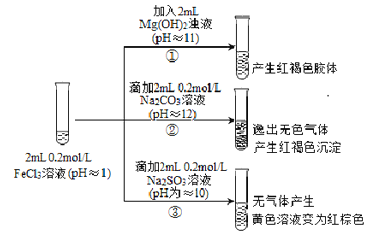
(1)①中反应的离子方程式是_________________。
(2)②中逸出的无色气体是_______________。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入少量盐酸酸化的BaCl2溶液,产生白色沉淀。 甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是______________。
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的。其实验方案是取Ⅰ中所得溶液少许进行__________离子的检验。
(4)受以上实验的启发,同学们对pH≈8的1mol/LNaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
实验操作及现象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液。溶液变无色 |
⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸馏水,溶液颜色变浅 |
Ⅰ.⑤的实验目的是___________。
Ⅱ.为探究④中溶液变无色的原因,进行如下实验:
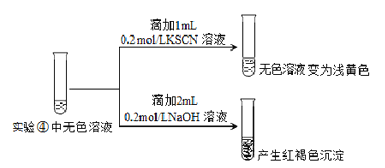
资料显示:FeF3溶液为无色。
用平衡移动原理解释红褐色沉淀产生的原因:_______________。
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与_____________________有关。