题目内容
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
| A.a、b不连接时,只有锌片上有气泡逸出 |
| B.a和b用导线连接时,铜片上发生的反应为:2H+ + 2e-=H2 ↑ |
| C.a和b是否用导线连接,装置中所涉及的化学反应都相同 |
| D.a和b用导线连接或接直流电源,锌片都能溶解 |
D
解析试题分析:a、b不连接时,未构成原电池,铜是氢后金属,不能与稀硫酸反应,锌是氢前金属,与稀硫酸容易反应,即Zn+H2SO4=ZnSO4+H2↑,放出氢气,故A选项正确;a和b用导线连接时,形成原电池,Zn是负极,Cu是正极,稀硫酸中氢离子移向正极,并且在正极上得到电子,发生还原反应,即2H+ + 2e-=H2 ↑,故B选项正确;a和b是否用导线连接,装置中所涉及的化学反应都是Zn+H2SO4=ZnSO4+H2↑,故C选项正确;a和b用导线连接时形成原电池,Zn作负极被腐蚀或溶解,a和b接直流电源的正、负极时形成电解池,Zn作阳极被腐蚀或溶解,a和b接直流电源的负、正极时形成电解池,Zn作阴极被保护,此时锌片不能溶解,故D选项错误。
考点:考查原电池和电解原理及金属的腐蚀,涉及金属活动性顺序、金属的化学腐蚀、锌铜原电池、正极反应式、电池总反应式、金属的电化学腐蚀及防护方法等。

练习册系列答案
相关题目
关于下图装置的叙述中正确的是( )
| A.电流由铁钉经过导线流向石墨棒 |
| B.该装置是一个简易的电解饱和食盐水的装置 |
C.石墨棒上发生的电极反应式: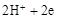 → →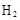 ↑ ↑ |
D.石墨棒上发生的电极反应式: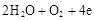 → →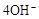 |
用Pt做电极,电解含C(Cu2+): C(Na+): C(Cl-)=1:2:4的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是
| A.阴极:2H++2e-=H2↑阳极:4OH-- 4e-=2H2O+O2↑ |
| B.阴极:2H++2e-=H2↑阳极:2Cl--2e-=Cl2↑ |
| C.阴极:Cu2++2e-=Cu阳极:4OH-- 4e-=2H2O+O2↑ |
| D.阴极:Cu2++2e-="Cu" 阳极:2Cl--2e-=Cl2↑ |
Cu2O 是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为:2Cu+H2O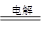 Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是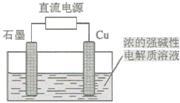
| A.石墨电极上产生氢气 |
| B.铜电极发生还原反应 |
| C.铜电极发生的电极反应为Cu—eˉ= Cu+ |
| D.当有0.2mol电子转移时,有0.1mol Cu2O生成 |
工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下: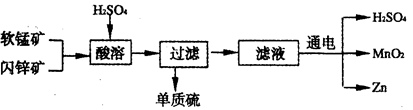
下列说法正确的是
| A.酸溶时,MnO2作还原剂 | B.可用盐酸代替硫酸进行酸溶 |
| C.原料硫酸可以循环使用 | D.在电解池的阴极处产生MnO2 |
某实验兴趣小组用如图所示装置实验,其中描述不合理的是
| A.Zn为负极 |
| B.H+向负极定向移动 |
| C.化学能转化为电能 |
| D.Cu电极反应:2H++2e-=H2↑ |
下列装置中,Fe腐蚀由快到慢的顺序为( )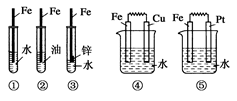
| A.⑤④③②① |
| B.⑤④①②③ |
| C.⑤③④①② |
| D.①②④③⑤ |
下列叙述正确的是
| A.在电解池的阴极和原电池的负极上都发生氧化反应 |
| B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2 |
| D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |

 2O3
2O3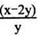 (忽略O3的分解)
(忽略O3的分解)