题目内容
【题目】常温下氢氧化锌在碱性溶液中的变化如图所示,横坐标为溶液的pH,纵坐标为Zn2+或ZnO![]() 的物质的量浓度的对数,下列说法正确的是( )
的物质的量浓度的对数,下列说法正确的是( )
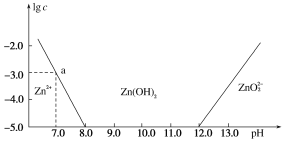
A. 依图中数据计算可得该温度下Zn(OH)2的溶度积(Ksp)=1×10-17
B. 溶液中加入足量氨水,发生反应的离子方程式为Zn2++4OH-===ZnO![]() +2H2O
+2H2O
C. 为提取工业废液中的Zn2+,可以控制溶液的pH在13左右
D. Zn2+在溶液中的存在形式与Al3+相似,碱性溶液中只以Zn(OH)2形式存在
【答案】A
【解析】
本题主要考查难溶电解质的溶解平衡及沉淀转化的本质;
A.Ksp=c(Zn2+)·c2(OH-);
B.氨水为弱电解质溶液,一水合氨部分电离不能拆成离子;
C.某废液中含Zn2+,为提取Zn2+,可形成沉淀过滤处理,先是开始沉淀,再是达到饱和溶液,但不能形成配离子再次溶解在溶液中,据此判断调控的pH范围;
D.向ZnCl2溶液中加入足量的氢氧化钠溶液,反应先产生Zn(OH)2沉淀,沉淀再生成ZnO22-的离子而溶解。
A.常温下,Zn2+离子浓度为10-5molL-1时,Zn2+离子已沉淀完全,溶液的pH=8.0,c(Zn2+)=10-5 molL-1,c(OH-)=10-6 molL-1,Ksp=c(Zn2+)c2(OH-)=10-5(10-6)2=10-17,故A正确;
B.离子方程式中一水合氨是弱电解质,不能拆成离子,锌离子和过量氨水反应生成锌氨络离子,Zn2++4NH3·H2O=[Zn(NH3)4]2++4H2O,故B错误;
C.某废液中含Zn2+,为提取Zn2+,可形成沉淀过滤处理,先是开始沉淀,再是达到饱和溶液,但不能形成配离子再次溶解在溶液中,根据图象,则可以控制pH的范围在8.0~12.0的范围内,溶液中锌离子浓度小于10-5 molL-1,可以近似认为锌离子不存在,故C错误;
D.向ZnCl2溶液中加入足量的氢氧化钠溶液,反应先产生Zn(OH)2沉淀,氢氧化钠过量后,沉淀溶解生成ZnO22-离子,反应过程的离子方程式可表示为:Zn2++2OH-═Zn(OH)2↓,Zn(OH)2+2OH=2H2O+ZnO22-,故D错误;

【题目】.I.(1)常温下三种弱酸 HA、H2B、HC,电离平衡常数的数值为 1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
① HA + HB- (少量)=A-+ H2B ,② H2B(少量) + C-=HB- + HC ,
③ HA(少量) + C-=A-+ HC 。则三种酸对应的电离平衡常数分别为(请填空)
HA | H2B | HC | ||
Ka | Ka1 | Ka2 | Ka3 | Ka4 |
数值 | ________ | ________ | ________ | ________ |
(2)常温下0.1 mol/L HA溶液加水稀释过程,下列表达式数据一定变小是_____。
A.c(A-) B.c(OH-) C.c(H+)c(OH-) D.c(OH-)/c(H+)
E.c(A-)/ c(H+) F. c(H+)/c(HA)
(3)某温度下,体积均为10 mL pH均为2 的HA溶液与HX溶液分别加水稀释至1000 mL,稀释后pH变化为:HA 3.2、HX 3.6,则该温度下HA电离平衡常数_____(填大于、等于或小于)HX,理由是_____;稀释过程中两溶液的c(OH-)将_____(变大、变小或不变)。
II.工业废水中常含有一定量的 Cr2O72- 和 CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
![]()
(4)转化过程中存在平衡 2CrO42- + 2H+![]() Cr2O72- + H2O,该转化过程中溶液颜色变化为_____,能说明反应到达平衡状态的是_____。
Cr2O72- + H2O,该转化过程中溶液颜色变化为_____,能说明反应到达平衡状态的是_____。
A.Cr2O72-和 CrO42-的浓度相同 B.ν正(Cr2O72-)=2 ν逆(CrO42-)
C.溶液的 pH 值保持不变 D.CrO42-不再转化为Cr2O72-
(5)若 1 L 转化后所得溶液中含铬元素质量为 28.6 g,CrO42-有 10/11 转化为Cr2O72-(已知铬元素相对原子质量为 52)。
① 转化后所得溶液中 c(Cr2O72-)=_____。
② 请写出该反应的平衡常数表达式 K=_________,已知:常温下该反应的平衡常数 K=1014,上述转化后所得溶液的 pH 为_____。