题目内容
【题目】按要求填空:
(1)已知4.5g的X气体中所含分子数约为9.03×1022,则该气体的摩尔质量为___________,标准状况下体积为_______________。
(2)标准状况下,由CO和CO2组成的6.72L混合气体的质量为9.6g。此混合物中CO和CO2的物质的量之比为_________,该混合气体的密度是相同状况下氢气密度的___________倍。
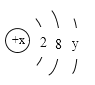
(3)某微粒的结构示意图如图所示,当x-y < 10时,该微粒是______________ (选填“阳离子”或“阴离子”或“原子”) ;当y=1的中性原子M跟y=6的中性原子N化合时,形成化合物的化学式为_______________。
【答案】30g/mol 3.36L 3:1 16 阴离子 Na2S
【解析】
根据n=m/M=N/NA进行计算摩尔质量。根据摩尔质量的计算公式计算其物质的量。根据微粒中的核电荷数和核外电子数的大小分析微粒种类。
(1)已知4.5g的X气体中所含分子数约为9.03×1022, 物质的量为9.03×1022/6.02×1023mol-1=0.15mol,则摩尔质量为4.5g/0.15mol=30g/mol。标况下体积为0.15mol×22.4L/mol=3.36L。
(2)假设一氧化碳的物质的量为xmol,二氧化碳的物质的量为ymol,则有x+y=6.72L÷22.4L/mol 28x+44y=9.6,则x=0.225,y=0.075,一氧化碳和二氧化碳的物质的量比为 3:1,该混合气体的平均摩尔质量为9.6g÷0.3mol=32g/mol,则该混合气体的密度与氢气的密度比等于相对分子质量之比,即为32/2=16。
(3) 当x-y < 10时,该微粒中核电荷数比核外电子数小,所以为阴离子;当y=1的中性原子M为钠原子,y=6的中性原子N为硫原子,二者化合为Na2S。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案