题目内容
17.下列解释事实的离子方程式不正确的是( )| A. | SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32- | |
| B. | 利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| C. | 向淀粉碘化钾溶液中加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2=2I2+2H20 | |
| D. | 用盐酸洗涤试管中的Cu(OH)2:Cu(OH)2+2H+=Cu2++2H2O |
分析 A.二氧化硫与水反应生成亚硫酸,亚硫酸为弱电解质,部分电离;
B.氢氧化钠与氧化铝反应生成偏铝酸钠和水;
C.酸性环境下碘离子能够被氧气氧化生成碘;
D.氢氧化铜与盐酸反应生成铜离子与水.
解答 解:A.SO2使紫色石蕊溶液变红色,离子方程式:SO2+H2O=H2SO3,H2SO3?H++HSO3-,故A错误;
B.利用NaOH溶液除去金属铝表面的氧化膜,离子方程式:Al2O3+2OH-═2AlO2-+H2O,故B正确;
C.酸性环境下碘离子能够被氧气氧化生成碘,离子方程式:4H++4I-+O2=2I2+2H20,故C正确;
D.用盐酸洗涤试管中的Cu(OH)2,反应生成氯化铜和水,离子方程式为:Cu(OH)2+2H+=Cu2++2H2O,故D正确;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质、离子方程式书写的方法是解题关键,注意化学式拆分是否正确,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.化学与生活密切相关,下列说法正确的是( )
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| D. | 乙烯和苯都能使溴水褪色,褪色的原因不同 |
8.下列关于甲、乙、丙、丁四种有机物说法正确的是( )


| A. | 四种物质中分别加入氯水,均有红棕色液体生成 | |
| B. | 四种物质中加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成 | |
| C. | 四种物质中加入NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成 | |
| D. | 乙发生消去反应得到两种烯烃 |
5.常温下,浓度均为0.l mol/L的下列四种盐溶液,其pH测定如下表所示:
下列说法正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
| A. | 四种溶液中,水的电离程度①>②>④>③ | |
| B. | Na2CO3和NaHCO3 溶液中,粒子种类相同 | |
| C. | 将等浓度的CH3COOH 和HClO溶液比较,pH小的是HClO | |
| D. | Na2CO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
12.下列有机物同分异构体数目判断错误的是( )
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C5H12 | 3 |
| B | 分子式为C5H10,能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,能与Na反应生成氢气 | 4 |
| D | 分子式为C4H8O2,能与NaHCO3反应 | 3 |
| A. | A | B. | B | C. | C | D. | D |
6.在密闭容器中,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示,且v(A)、v(B)、v(C)之间有以下关系:v(B)=3v(A)、3v(C)=2v(B),则此反应可表示为( )
| A. | 2A+3B═2C | B. | A+3B═2C | C. | 3A+B═2C | D. | 3A+B═C |
7.电解水这一变化中,没有变化的粒子是( )
| A. | 水分子 | B. | 水原子 | C. | 氢、氧两种原子 | D. | 以上都不是 |
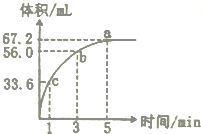 某“学习小组”研究影响化学反应速率的因素.向10 mL某浓度的H2O2溶解中加入一定量MnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示,
某“学习小组”研究影响化学反应速率的因素.向10 mL某浓度的H2O2溶解中加入一定量MnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示,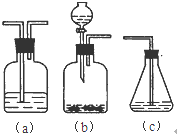
 (填字母符号)
(填字母符号)