题目内容
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)基态Fe原子有______个未成对电子,Fe3+的电子排布式为______。可用硫氰化钾检验Fe3+,形成的配合物的颜色为______。
(2)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。1mol乙醛分子中含有的键的数目为______。乙醛中碳原子的杂化轨道类型为______,乙酸的沸点明显高于乙醛,其主要原因是______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。
(3)Al单质为面心立方晶体,其晶胞边长a0.405nm,晶胞中铝原子的配位数为______。列式表示Al单质的密度______ gcm-3。(阿伏加德罗常数用NA表示)
【答案】4 3d5 血红色 6NA sp2和sp3 乙酸分子间存在氢键,而乙醛分子间不能形成氢键 16 12 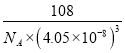
【解析】
根据基态原子的电子排布确定其未成对电子数及其离子的价电子排布;根据乙醛的分子结构确定其中σ键的数目及其碳原子的杂化方式 ;根据氢键对物质的溶解性的影响分析有机物的溶解性;根据晶胞结构和均摊法确定晶胞中的原子数;根据晶胞的质量和体积确定其密度。
(1)Fe是26号元素,基态Fe原子的价电子排布式为3d64s2,故其有4个未成对电子,其在化学反应中优先失去最外层电子,故Fe3+的电子排布式为[Ar] 3d5。实验室常用硫氰化钾检验Fe3+,形成的一系列配合物在水溶液中的的颜色为血红色。
(2)乙醛的结构简式为CH3CHO,分子中除C=O键是双键外,其余的均为σ键,双键中有一个是σ键,因此,1mol乙醛分子中含有的键的数目为6NA。乙醛中醛基中的碳原子形成3个σ键和一个π,故其杂化轨道类型为sp2,而甲基中的碳原子只形成4个,σ键,故该碳原子的杂化方式为sp3;乙酸的沸点明显高于乙醛,其主要原因是乙酸分子间存在氢键,而乙醛分子间不能形成氢键。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中占有氧原子的个数为4+8![]() ,所以,根据化学式Cu2O可知,该晶胞中有16个铜原子。
,所以,根据化学式Cu2O可知,该晶胞中有16个铜原子。
(3)Al单质为面心立方晶体,其晶胞边长a0.405nm,面心立方的金属原子的配位数均为12,故晶胞中铝原子的配位数为12。该晶胞中占有铝原子的数目为8![]() ,则晶胞的质量为
,则晶胞的质量为![]() ,晶胞的体积为
,晶胞的体积为![]() ,所以,Al单质的密度为
,所以,Al单质的密度为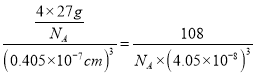 gcm-3。
gcm-3。

 阅读快车系列答案
阅读快车系列答案【题目】某研究性学习小组通过测量溶液的电导率(电导率越大,说明溶液的导电能力越强)探究沉淀溶解平衡,各物质的电导率数据如下:
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
物质 |
固体 |
|
饱和溶液 |
饱和溶液 |
NaCl溶液 |
|
饱和溶液 |
电导率 | 0 | 7 | 37 | 389 | 1989 | 1138 | 13 |
下列分析不正确的是
A. ![]() 固体中不存在自由移动的离子
固体中不存在自由移动的离子
B. 与①、②对比,可说明③中![]() 发生了电离
发生了电离
C. ⑤、⑥等体积混合后过滤,推测滤液的电导率一定大于13
D. 将①中固体加入④中,发生反应:![]()
