题目内容
9.比较锌和二氧化锰分别与盐酸的反应,下列叙述错误的是( )| A. | 若Zn和MnO2都是足量的,则前一反应中盐酸全部被还原,后一反应中盐酸部分被氧化 | |
| B. | 两个都是氧化还原反应 | |
| C. | 盐酸都是被还原 | |
| D. | 等物质的量的Zn和MnO2分别与足量的浓盐酸反应,转移的电子数相等 |
分析 反应4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Cl元素化合价升高,被氧化,HCl为还原剂,Mn元素化合价降低,被还原,MnO2为氧化剂,反应2HCl+Zn=ZnCl2+H2↑中,H元素化合价降低,被还原,HCl为氧化剂,Zn元素化合价升高,被氧化,Zn为还原剂,据此分析.
解答 解:A、反应4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,部分Cl元素化合价升高,所以盐酸部分被氧化,反应2HCl+Zn=ZnCl2+H2↑中,H元素化合价降低,则全部被还原被还原,故A正确;
B、反应4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑和反应2HCl+Zn=ZnCl2+H2↑中,都有化合价变化,所以都是氧化还原反应,故B正确;
C、反应4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,部分Cl元素化合价升高,所以盐酸部分被氧化,故C错误;
D、反应4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑和反应2HCl+Zn=ZnCl2+H2↑中,等物质的量的Zn和MnO2分别反应,生成1mol氢气和1mol氯气,所以转移的电子数相等,故正确;
故选:C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从化合价角度分析,题目难度中等.

练习册系列答案
相关题目
20.用10mL的0.1mol•L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
| A. | 3:2:2 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:1:1 |
1.对已达化学平衡的下列反应 2X(g)+Y(g)?2Z(g),减小压强时,对反应产生的影响是( )
| A. | 逆反应速率增大,正反应速率减小 | B. | 逆反应速率减小,正反应速率增大 | ||
| C. | 逆反应速率先增大后减小 | D. | 正反应速率先减小后增大 |
18.下列物质中含原子个数最多的是( )
| A. | 0.4 molO2 | B. | 4℃时5.4mL水 | ||
| C. | 10g氖 | D. | 6.02×1022 个CO2分子 |
19.密闭的烧瓶里盛放气体A,在25℃时建立平衡:2A(g)?B(g)△H<0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是( )
| A. | 平均相对分子质量 | B. | 密度 | ||
| C. | 容器内的压强 | D. | 物质的量 |

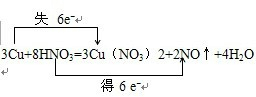 .
.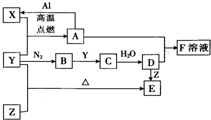 已知X、Y、Z为单质,其它为化合物.其中Y为气体,F溶液呈黄色,E是常见的温室气体,它们之间存在如下的转化关系(部分产物已经略去).请回答下列问题:
已知X、Y、Z为单质,其它为化合物.其中Y为气体,F溶液呈黄色,E是常见的温室气体,它们之间存在如下的转化关系(部分产物已经略去).请回答下列问题: