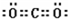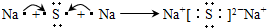题目内容
有A、B、C、D四种元素.已知A的最高正价与其最低负价的代数和为6;A、C、D次外层电子数都是8个,其中A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,C2-离子与氩原子具有相同的电子层结构;B有两个电子层,其最高正化合价与最低负化合价的代数和为零.试回答下列下列问题:
(1)写出A、B、C三种元素的元素符号:A
(2)DA的电子式为
 .
.
(3)A、B、C、D四种元素原子半径最大的是
(4)A、B、C、D四种元素的最高价氧化物所对应的水化物中酸性最强的是
(1)写出A、B、C三种元素的元素符号:A
Cl
Cl
BC
C
CS
S
(2)DA的电子式为


(3)A、B、C、D四种元素原子半径最大的是
K
K
(填元素符号).(4)A、B、C、D四种元素的最高价氧化物所对应的水化物中酸性最强的是
HClO4
HClO4
(填化学式,下同 ),碱性最强的是KOH
KOH
.分析:A、B、C、D四种元素,C2-离子与氩原子具有相同的电子层结构,则C为硫元素;B有两个电子层,其最高正化合价与最低负化合价的代数和为零,最外层电子数为4,故B为碳元素;A的最高正价与其最低负价的代数和为6,则A处于ⅦA族,A次外层电子数是8个,则A为氯元素;D次外层电子数是8个,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,A为氯元素,A离子带1个单位负电荷,核外电子数为18,所以D的阳离子带1个单位正电荷,核外电子数为18,故D为钾元素.
解答:解:A、B、C、D四种元素,C2-离子与氩原子具有相同的电子层结构,则C为硫元素;B有两个电子层,其最高正化合价与最低负化合价的代数和为零,最外层电子数为4,故B为碳元素;A的最高正价与其最低负价的代数和为6,则A处于ⅦA族,A次外层电子数是8个,则A为氯元素;D次外层电子数是8个,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,A为氯元素,A离子带1个单位负电荷,核外电子数为18,所以D的阳离子带1个单位正电荷,核外电子数为18,故D为钾元素.
故A为氯元素,B为碳元素;C为硫元素;D为钾元素.
(1)由上述分析可知,A为Cl;B为C;C为S.
故答案为:Cl、C、S.
(2)A为氯元素,D为钾元素,DA为KCl,由钾离子与氯离子构成,电子式为 .
.
故答案为: .
.
(3)电子层越大原子半径越大,同周期原子序数越大,原子半径越小,所以原子半径K>S>Cl>C.所以四种元素原子半径最大的是K.
故答案为:K.
(4)非金属性越强,最高价氧化物所对应的水化物中酸性越强,非金属性Cl>S>C,所以HClO4酸性最强.金属性越强,最高价氧化物所对应的水化物中碱性越强,K的金属性最强,所以KOH碱性最强.
故答案为:HClO4;KOH.
故A为氯元素,B为碳元素;C为硫元素;D为钾元素.
(1)由上述分析可知,A为Cl;B为C;C为S.
故答案为:Cl、C、S.
(2)A为氯元素,D为钾元素,DA为KCl,由钾离子与氯离子构成,电子式为
 .
.故答案为:
 .
.(3)电子层越大原子半径越大,同周期原子序数越大,原子半径越小,所以原子半径K>S>Cl>C.所以四种元素原子半径最大的是K.
故答案为:K.
(4)非金属性越强,最高价氧化物所对应的水化物中酸性越强,非金属性Cl>S>C,所以HClO4酸性最强.金属性越强,最高价氧化物所对应的水化物中碱性越强,K的金属性最强,所以KOH碱性最强.
故答案为:HClO4;KOH.
点评:考查结构与位置关系、电子式、元素周期律等,难度不大,推断元素是关键,注意基础知识的掌握.

练习册系列答案
相关题目