题目内容
【题目】为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是

A. N极是负极
B. 该装置工作时,H+从右侧经阳离子交换膜移向左侧
C. 负极的电极反应为:(C6H10O5)n+7H2O﹣24e﹣═6CO2↑+24H+
D. 物质X是OH-
【答案】C
【解析】由题意利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,即为原电池,由图N极通O2,M极为有机物,则N极为正极发生还原反应,M极为负极,发生氧化反应,负极的电极反应为(C6H10O5)n]+7nH2O﹣24ne﹣═6nCO2↑+24nH+,原电池中阳离子移向正极,A.由图N极通O2,则N极为正极,选项A错误;B.原电池中阳离子移向正极,该装置工作时,H+从左侧经阳离子交换膜转向右侧,选项B错误;C.M极为有机物,M极为负极,发生氧化反应,负极的电极反应为(C6H10O5)n]+7nH2O﹣24ne﹣═6nCO2↑+24nH+,故C正确;D.由图N极通O2,则N极为正极,O2得电子结合H+生成水,物质X为水,选项D错误。答案选C。

【题目】以下是25℃时几种难溶电解质的溶度极数值:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.0×10-12 | 1.0×10-20 | 1.0×10-16 | 1.0×10-38 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为___________(填名称)而除去。
(2)①中加入的试剂应选择________为宜,其原因是_______________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式__________________________________。
(4) 向浓度均为0.1mol/L-1的Fe(NO3)3和Cu(NO3)2混合溶液中,逐滴加入NaOH.下列示意图表示生成沉淀的总物质的量与加入NaOH的体积的关系,合理的是(____)
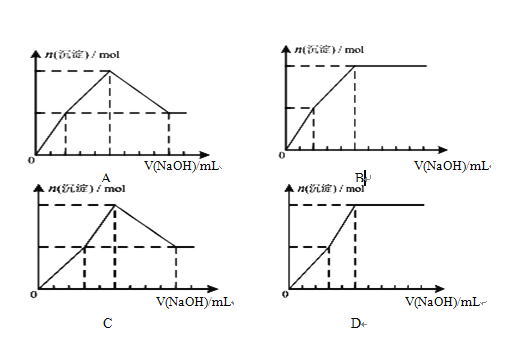
(5)若将某MgCl2、FeCl3均为0.1 mol·L-1混合溶液中的pH用MgO调整至pH=4,则溶液中![]() 比值约为______________________。
比值约为______________________。



