题目内容
科研、生产中常涉及钠、硫及其化合物.(1)实验室用无水乙醇处理少量残留的金属钠,化学方程式为______.要清洗附着在试管壁上的硫,可用的试剂是______.
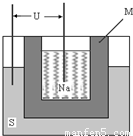
(2)如图为钠硫高能电池的结构示意图.该电池的工作温度为200℃左右,电池反应为
2Na+xS=Na2Sx,正极的电极反应式为______.M(由Na2O和Al2O3制得)的两个作用是______.与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池______倍.
(3)Na2S溶液中离子浓度由达到小的顺序为______,向该溶液中加入少量固体CuSO4,溶液pH______(填“增大”、“减小”或“不变”). Na2S溶液长期放置有硫析出,是因为______(用离子方程式表示).
【答案】分析:(1)根据乙醇能和钠反应的性质以及硫在二硫化碳中的溶解性知识来回答;
(2)原电池正极发生得电子的还原反应,结合原电池的构成条件和题意实际情况来分析M的作用,根据铅蓄电池的工作原理和钠硫高能电池的工作原理来回答;
(3)根据盐的电离和离子的水解知识来比较离子浓度大小,根据加入硫酸铜后所发生的反应情况来判断pH的变化,根据硫离子的强还原性来回答.
解答:解:(1)乙醇能和钠反应,方程式为:2CH3CH2OH+2Na=2CH3CH2ONa+H2↑,硫极易溶于二硫化碳,微溶于酒精,不溶于水,还能和热的氢氧化钠溶液反应,故答案为:2CH3CH2OH+2Na=2CH3CH2ONa+H2↑;CS2[或(热)NaOH溶液];
(2)原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e-=Sx2-(或2Na++xS+2e-=Na2Sx),M作为电解质的同时又将钠和硫隔开,与铅蓄电池相比,当消耗相同质量的负极活性物质铅和钠时,铅成为铅离子时转移电子的物质的量是钠成为钠离子时转移的电子的物质的量的4.5倍,即钠硫电池的理论放电量是铅蓄电池4.5倍,故答案为:xS+2e-=Sx2-(或2Na++xS+2e-=Na2Sx)、离子导电(导电或电解质)和隔离钠与硫、4.5;
(3)硫化钠电离出的离子有钠离子和硫离子,理论上钠离子浓度是硫离子的2倍,故c(Na+)>c(S2-),但少量的硫离子水解,第一步水解强于第二步,两步水解均生成氢氧根,故c(S2-)>c(OH-)>c(HS-),溶液显碱性,故氢离子浓度最小,加硫酸铜后,溶液由碱性硫化钠溶液变为中性硫酸钠溶液,故pH 减小,故答案为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);减小;
(4)硫离子有很强还原性,很容易被空气氧化,反应方程式为:2S2-+O2+2H2O=2S↓+4OH-,故答案为:2S2-+O2+2H2O=2S↓+4OH-.
点评:本题是一道开放性的题目,同时即考查了有机物知识、电化学知识还考查了溶液的水解和电离知识,难度很大.
(2)原电池正极发生得电子的还原反应,结合原电池的构成条件和题意实际情况来分析M的作用,根据铅蓄电池的工作原理和钠硫高能电池的工作原理来回答;
(3)根据盐的电离和离子的水解知识来比较离子浓度大小,根据加入硫酸铜后所发生的反应情况来判断pH的变化,根据硫离子的强还原性来回答.
解答:解:(1)乙醇能和钠反应,方程式为:2CH3CH2OH+2Na=2CH3CH2ONa+H2↑,硫极易溶于二硫化碳,微溶于酒精,不溶于水,还能和热的氢氧化钠溶液反应,故答案为:2CH3CH2OH+2Na=2CH3CH2ONa+H2↑;CS2[或(热)NaOH溶液];
(2)原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e-=Sx2-(或2Na++xS+2e-=Na2Sx),M作为电解质的同时又将钠和硫隔开,与铅蓄电池相比,当消耗相同质量的负极活性物质铅和钠时,铅成为铅离子时转移电子的物质的量是钠成为钠离子时转移的电子的物质的量的4.5倍,即钠硫电池的理论放电量是铅蓄电池4.5倍,故答案为:xS+2e-=Sx2-(或2Na++xS+2e-=Na2Sx)、离子导电(导电或电解质)和隔离钠与硫、4.5;
(3)硫化钠电离出的离子有钠离子和硫离子,理论上钠离子浓度是硫离子的2倍,故c(Na+)>c(S2-),但少量的硫离子水解,第一步水解强于第二步,两步水解均生成氢氧根,故c(S2-)>c(OH-)>c(HS-),溶液显碱性,故氢离子浓度最小,加硫酸铜后,溶液由碱性硫化钠溶液变为中性硫酸钠溶液,故pH 减小,故答案为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);减小;
(4)硫离子有很强还原性,很容易被空气氧化,反应方程式为:2S2-+O2+2H2O=2S↓+4OH-,故答案为:2S2-+O2+2H2O=2S↓+4OH-.
点评:本题是一道开放性的题目,同时即考查了有机物知识、电化学知识还考查了溶液的水解和电离知识,难度很大.

练习册系列答案
相关题目
科研、生产中常涉及钠、硫及其化合物。
(1)工业上用Na2CO3溶液处理水垢中的CaSO4,反应的离子方程式为___________________;实验室中,Na2S溶液长期放置有硫析出,原因为___________________(用离子方程式表示)。
(2)下图是大型蓄电系统的示意图。左右两侧为电解质储罐,中央为电池,反应原理为: ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
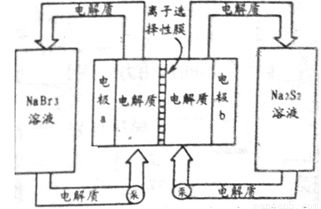
当蓄电池放电时,电池中Na+的移动方向是_________(填“a→b”或“b→a”),电极a的电极反应式为_______________;当蓄电池处于充电状态时,电极b的电极反应式为___________。用该电池做电源,采用惰性电极电解200 mL 1 mol·L-1的AgNO3溶液,当阴极质量增加2.16 g时,电解后溶液的pH为_________(不考虑溶液体积变化)。
(3)工业上,用Na2SO3溶液作为吸收液可吸收烟气中的SO2,吸收SO2过程中,溶液pH与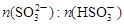 关系如下表:
关系如下表:
|
|
91∶9 |
1∶1 |
9∶91 |
|
pH(25℃) |
8.2 |
7.2 |
6.2 |
①由上表判断,NaHSO3溶液显________性,用平衡原理解释:__________________。
②当溶液呈中性时,溶液中离子浓度的大小关系为_____________________________。
 (2011?山东)科研、生产中常涉及钠、硫及其化合物.
(2011?山东)科研、生产中常涉及钠、硫及其化合物. S=Na2
S=Na2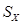 ,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的
倍。
,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的
倍。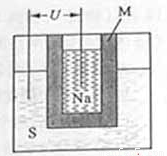
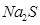 溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体
溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体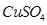 ,溶液Ph (填“增大”“减小”或“不变”),
,溶液Ph (填“增大”“减小”或“不变”),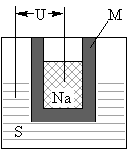 (1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为___________________________________。要清洗附着在试管壁上的硫,可用的试剂是________。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为___________________________________。要清洗附着在试管壁上的硫,可用的试剂是________。