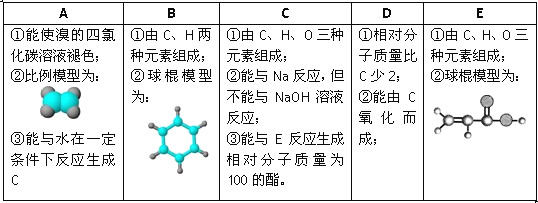
题目内容
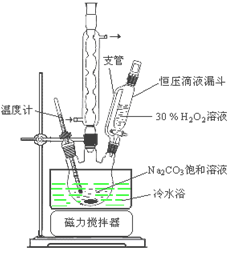
【题目】过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
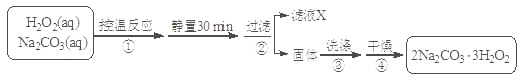
已知:主反应:2Na2CO3(aq) + 3H2O2(aq)![]() 2Na2CO3·3H2O2(s) ΔH < 0
2Na2CO3·3H2O2(s) ΔH < 0
副反应:2H2O2= 2H2O + O2↑;50℃时2Na2CO3·3H2O2(s) 开始分解。
请回答下列问题:
(1)步骤①的关键是 ,原因是 。
(2)在滤液X中加入适量NaCl固体目的是_________________。
(3)步骤③中选用无水乙醇洗涤产品的目的是 。
(4)下列物质中,会引起过碳酸钠失效的有 。
A.NaHCO3 | B.Na2SO3 | C.Na2SiO3 | D.HCl |
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶解→加入BaCl2溶液→过滤→洗涤→干燥→称量。需要直接测定的物理量有: (用字母表示并注明其含义)。产品中过碳酸钠质量分数的表达式为: 。
【答案】⑴控制温度;制备过碳酸钠是放热反应,防止H2O2和过碳酸钠分解⑵增大钠离子浓度,有利于过碳酸钠的析出(盐析作用)⑶减少过碳酸钠的溶解损失,并带走水分利于干燥; ⑷BD;⑸样品的质量m1g、沉淀的质量m2g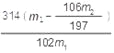
【解析】试题分析:(1)由于制备过碳酸钠的反应2Na2CO3(aq) + 3H2O2(aq)![]() 2Na2CO3·3H2O2(s) ΔH < 0是放热反应,50℃时2Na2CO3·3H2O2(s) 开始分解,H2O2受热也分解,所以步骤①的关键是控制温度。(2)在滤液X中加入适量NaCl固体可以增大溶液中钠离子浓度,从而降低过碳酸钠的溶解度,因此可析出过碳酸钠。(3)过碳酸钠在有机溶剂中的溶解度小,所以骤③中选用无水乙醇洗涤产品的目的是减少过碳酸钠的溶解损失,并带走水分利于过碳酸钠的干燥。 (4) A.过碳酸钠与NaHCO3不反应,不能使过碳酸钠失效,错误;B.Na2SO3具有还原性,而过碳酸钠具有强氧化性,因此能使过碳酸钠失效,正确;C.过碳酸钠与Na2SiO3不反应,不能使过碳酸钠失效,错误;D.HCl与过碳酸钠会发生反应,所以HCl和亚硫酸钠能使过碳酸钠失效,正确;(5)要测定过碳酸钠产品中的纯度,则需要称量样品的质量以及反应中生成的碳酸钡的质量,即需要直接测定的物理量有样品的质量m1g、沉淀的质量m2g。设样品中过碳酸钠和碳酸钠的物质的量分别是xmol和ymol,则314x+106y=m1,2x+y=m2/197,解出x=
2Na2CO3·3H2O2(s) ΔH < 0是放热反应,50℃时2Na2CO3·3H2O2(s) 开始分解,H2O2受热也分解,所以步骤①的关键是控制温度。(2)在滤液X中加入适量NaCl固体可以增大溶液中钠离子浓度,从而降低过碳酸钠的溶解度,因此可析出过碳酸钠。(3)过碳酸钠在有机溶剂中的溶解度小,所以骤③中选用无水乙醇洗涤产品的目的是减少过碳酸钠的溶解损失,并带走水分利于过碳酸钠的干燥。 (4) A.过碳酸钠与NaHCO3不反应,不能使过碳酸钠失效,错误;B.Na2SO3具有还原性,而过碳酸钠具有强氧化性,因此能使过碳酸钠失效,正确;C.过碳酸钠与Na2SiO3不反应,不能使过碳酸钠失效,错误;D.HCl与过碳酸钠会发生反应,所以HCl和亚硫酸钠能使过碳酸钠失效,正确;(5)要测定过碳酸钠产品中的纯度,则需要称量样品的质量以及反应中生成的碳酸钡的质量,即需要直接测定的物理量有样品的质量m1g、沉淀的质量m2g。设样品中过碳酸钠和碳酸钠的物质的量分别是xmol和ymol,则314x+106y=m1,2x+y=m2/197,解出x=![]() ,所以产品中过碳酸钠质量分数的表达式为
,所以产品中过碳酸钠质量分数的表达式为![]() 。
。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案【题目】某原电池总反应的离子方程式是Fe+2Fe3+=3Fe2+ , 该原电池的组成正确的是( )
Zn | A | B | C | D |
正极 | Fe | C(石墨) | Ag | Zn |
负极 | Cu | Fe | Fe | Fe |
电解质溶液 | FeCl3 | Fe2 (SO4)3 | H2SO4 | FeCl3 |
A.A
B.B
C.C
D.D