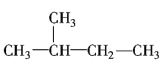题目内容
【题目】某温度下,当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则此状态下,下列热化学方程式正确的是 ( )
①N2(g)+3H2(g) = 2NH3(g) ΔH=-92.4 kJ/mol
②N2(g)+3H2(g) = 2NH3(g) ΔH=-46.2 kJ/mol
③NH3(g) =![]() N2(g)+
N2(g)+![]() H2(g) ΔH=+46.2 kJ/mol
H2(g) ΔH=+46.2 kJ/mol
④2NH3(g) = N2(g)+3H2(g) ΔH=-92.4 kJ/mol
A.①②B.①③C.①②③D.全部
【答案】B
【解析】
①n(NH3)=![]() =
=![]() mol,则分解1molNH3吸收17×2.72kJ=46.24kJ能量,生成1molNH3放出46.24kJ能量,则生成2molNH3放出2×46.24kJ≈92.4kJ,故①正确;
mol,则分解1molNH3吸收17×2.72kJ=46.24kJ能量,生成1molNH3放出46.24kJ能量,则生成2molNH3放出2×46.24kJ≈92.4kJ,故①正确;
②根据①分析,生成2molNH3放出2×46.24kJ≈92.4kJ,故②错误;
③生成1molNH3放出46.24kJ能量,则分解1molNH3吸收46.24kJ能量,故③正确;
④分解2molNH3吸收92.4kJ能量,而不是放出,故④错误;
答案选B。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】根据下面的合成路线图完成下面小题

【1】化合物D的名称为( )
A.乙醇B.乙烷C.葡萄糖D.乙酸
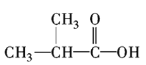
【2】乳酸的一种合成方法如图所示,下列说法正确的是( )

A.步骤①、②分别是加成反应、取代反应
B.蛋白质水解也可生成乳酸
C.丙酸烃基上的二氯代物有2种
D.乳酸与丙烯完全燃烧的产物相同
【3】有下列三种有机物,实现它们之间相互转化所选试剂(均足量)正确的是____
a转化为b | a转化为c | c转化为b | |
A | NaOH | Na | CO2 |
B | Na2CO3 | NaOH | HCl |
C | NaHCO3 | NaOH | CO2 |
D | NaHCO3 | Na2CO3 | HCl |
A.AB.BC.CD.D
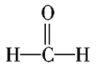
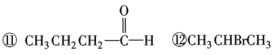
【4】化合物A(C4H8Br2)可由下列反应制得,C4H10O![]() C4H8
C4H8![]() C4H8Br2,则A的结构式不可能的是( )
C4H8Br2,则A的结构式不可能的是( )
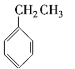
A.![]() B.
B.![]()
C.![]() D.
D.![]()