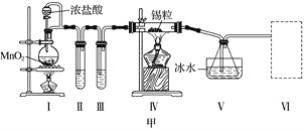
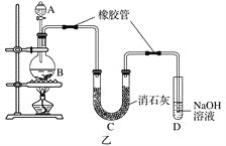
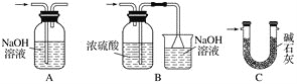
题目内容
【题目】足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50 mL,下列说法正确的是 ( )
A. 混合气体中含NO21.12 L B. 消耗氧气的体积为1.68 L
C. 此反应过程中转移的电子为0.3 mol D. 参加反应的硝酸是0.4mol
【答案】D
【解析】
标况下2.24L混合气体的物质的量为:![]() =0.1mol;50mL 4mol/L的氢氧化钠溶液中氢氧化钠的物质的量为:4mol/L×0.05L=0.2mol,
=0.1mol;50mL 4mol/L的氢氧化钠溶液中氢氧化钠的物质的量为:4mol/L×0.05L=0.2mol,
A.铜离子恰好沉淀时,反应后的溶质为硝酸钠,根据钠离子守恒可知硝酸钠中硝酸根离子的物质的量为0.02mol,根据氮原子守恒可得硝酸的物质的量为:0.1mol+0.2mol=0.3mol,故A错误;
B.生成氢氧化铜的物质的量为:0.2mol×![]() =0.1mol,反应消耗的铜的物质的量为0.1mol,0.1mol铜完全反应失去0.2mol电子,根据电子守恒,氧气得到的电子与铜失去的电子一定相等,则消耗氧气的物质的量为:
=0.1mol,反应消耗的铜的物质的量为0.1mol,0.1mol铜完全反应失去0.2mol电子,根据电子守恒,氧气得到的电子与铜失去的电子一定相等,则消耗氧气的物质的量为:![]() =0.05mol,消耗标况下氧气的体积为:22.4L/mol×0.05mol=1.12L,故B错误;
=0.05mol,消耗标况下氧气的体积为:22.4L/mol×0.05mol=1.12L,故B错误;
C.根据B的分析可知,反应转移的电子为0.2mol,故C错误;
D.设NO的物质的量为x、二氧化氮的物质的量为y,则x+y=0.1,根据电子守恒可得:3x+y=0.2,解得:x=0.05mol、y=0.05mol,所以混合气体中二氧化氮的体积为1.12L,故D正确;
故选D.

【题目】X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金属性最强的在周期表中的位置是________________________________;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是____________________。
(2)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_______(填化学
式),其电离方程式为_____________________________________。
(3)M与Z相比,非金属性较强的是_____________(填元素名称),请从原子结构的角度说明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
请配平,当有0.5 mol H2O2参加此反应,电子转移的个数为______________________。
【题目】根据下列实验操作和现象所得出的结论错误的是
选项 | 操作 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
B | 向盛有浓氨水的锥形瓶中通入氧气,并将灼热铂丝置于液面上方 | 铂丝保持红热,且瓶内有白烟产生 | 氨的催化氧化反应为放热反应 |
C | 向盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液 | 溶液变成棕黄色,一段时间后,溶液中出现气泡,随后有红褐色沉淀生成 | Fe2+催化H2O2分解产生O2;H2O2分解反应放热,促进Fe2+的水解平衡正向移动 |
D | 向浓度均为0.1mol/L的MgCl2和CuC12的混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
A. A B. B C. C D. D