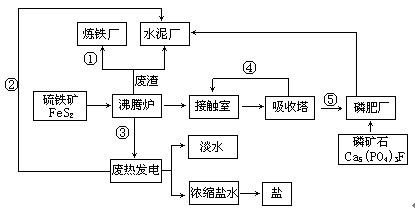
题目内容
硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。
(1)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。溶液由棕黄色变为浅绿色用离子方程式表示为_____,后又由浅绿色变为棕黄色的离子方程式为_____。
(2)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCI为原料可以合成有重要用途的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
写出反应反应Ⅳ的化学方程式 ;
反应III中氧化剂与还原剂的物质的量之比为__ __;
反应V在25'C、40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是 。
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下能使SO2分解,减小工业废气对环境的影响,它由铁酸锌(ZnFe2O4)经高温还原制得,转化流程如下图所示: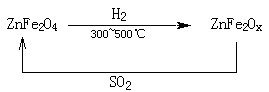
若2molZnFe2Ox与SO2反应可生成 0.75molS,x= ,写出铁酸锌高温下被还原生成氧缺位铁酸锌的化学方程式
(4)石灰石-石膏湿法烟气脱硫工艺技术的原理是烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4.2H2O),写出该反应的化学方程式 。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则可生产石膏 t。
(共16分)(1)SO2 + 2Fe3+ + 2H2O=SO42- + 2Fe2+ + 4H+(2分)
3Fe2+ + NO3- + 4H+=3Fe3+ + NO↑+ 2H2O(2分)
(2)NH4HCO3 + CaSO4 + NH3=CaCO3↓+ (NH4)2SO4 (2分) 1:4(1分)
K2SO4在乙二醇溶液中的溶解度小(1分)
(3)3.25(2分) 4ZnFe2O4 + 3H2 4ZnFe2O3.25 + 3H2O(2分)
4ZnFe2O3.25 + 3H2O(2分)
(4)2CaSO4 + 2SO2 + O2 + 4H2O=2(CaSO4.2H2O)+2CO2 (2分) 38.7(2分)
解析试题分析:(1)SO2具有还原性,铁离子具有氧化性,铁离子能把SO2氧化生成硫酸,而铁离子被还原为亚铁离子,所以溶液由棕黄色变为浅绿色,反应的离子方程式是SO2 + 2Fe3+ + 2H2O=SO42- + 2Fe2+ + 4H+。由于在酸性条件下,NO3-具有强氧化性,能把亚铁离子氧化生成铁离子,因此又由浅绿色变为棕黄色,反应的离子方程式为3Fe2+ + NO3- + 4H+=3Fe3+ + NO↑+ 2H2O。
(2)反应Ⅳ的反应物有硫酸钙、碳酸氢铵和氨气,生成物之一是碳酸钙,则根据原子守恒可知,另外一种生成物是硫酸铵,因此反应的化学方程式是NH4HCO3 + CaSO4 + NH3=CaCO3↓+ (NH4)2SO4。反应Ⅲ中碳的化合价从0价升高到+2价,失去2个电子,发生氧化反应,碳是还原剂。S元素的化合价从+6价降低到-2价,得到8个电子,发生还原反应,即硫酸钙是氧化剂。反应根据电子的得失守恒可知,在反应中氧化剂与还原剂的物质的量之比为1:4。由于K2SO4在乙二醇溶液中的溶解度小,能够形成晶体而析出,因此符合复分解反应发生的条件。
(3)ZnFe2OX中Fe的平均价态为+(x-1),而在生成物中铁的化合价是+3价,则铁在反应中失去(3-x+1)个电子。而SO2→S 中S的化合价从+4价降低到0价,得到4个电子,所以根据电子的得失守恒可知,2mol×2×(3-x+1)=0.75×4,解得x=3.25。所以铁酸锌高温下被还原生成氧缺位铁酸锌的化学方程式为4ZnFe2O4 + 3H2 4ZnFe2O3.25 + 3H2O。
4ZnFe2O3.25 + 3H2O。
(4)根据原子守恒可知,反应中还应该有CO2生成,因此反应的化学方程式是2CaSO4 + 2SO2 + O2 + 4H2O=2(CaSO4.2H2O)+2CO2 。据硫原子守恒可知:
S~~~~~~CaSO4·2H2O
32t 172t
300t·2.5%·96% m
解得m= =38.7t
=38.7t
考点:考查SO2、硝酸以及铁离子和亚铁离子的性质;氧化还原反应方程式的书写以及有关计算;反应条件的控制;根据方程式进行的有关计算等

工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?________________________________________________________。
(2)在400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:__________________________________________。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?________(填“是”或“否”),是否可以增大该反应放出的热量?________(填“是”或“否”)。
(4)为提高SO3吸收率,实际生产中用________吸收SO2。
(5)已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.9 kJ·mol-1,计算每生产1万吨98%的硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需_______________________ _。
(2)酸浸时,为了提高浸取率可采取的措施有_____________________________
______________________________________________________(答出两点)。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72—,写出此反应的离子方程式:_____________________________________________________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72—转化为CrO42—。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR―→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是_______________________________。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:__________________________________________________。
下列关于化工生产原理的几种叙述中,均符合目前工业生产实际情况的是( )
| A.石油是烃的混合物,石油工业中采用干馏的方法把石油分成不同沸点范围的产物 |
| B.氯气和氢气混合在光照条件下生成氯化氢,再用水吸收生成盐酸 |
| C.二氧化硫在接触室被氧化成三氧化硫,再在吸收塔内被水吸收制成浓硫酸 |
| D.合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体来说氨的产率很高 |
研究气体在固体表面反应的化学已经成为化学学科的一个重要分支,它涉及生产、生活中的许多重要领域。下列不属于气体与固体作用的表面化学研究领域的是( )。
| A.合成氨工业是将氮气和氢气在铁催化剂的表面转化成氨气 |
| B.在燃料电池中,氢气和氧化剂在催化剂表面反应所产生的能量转化为电能 |
| C.汽车中装有催化器,能将尾气中一氧化碳和氮氧化物转化为二氧化碳和氮气 |
| D.加酶洗衣粉的乳化作用能将衣物纤维表面的油渍洗去 |
 ,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为 (用含a的代数式表示)。
,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为 (用含a的代数式表示)。