题目内容
【化学与技术】
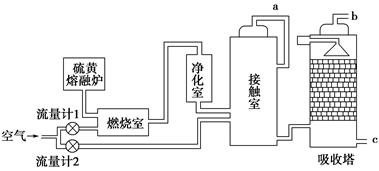
下图表示某些化工生产的流程(有的反应条件和产物已略去)
请回答下列问题:
(1)流程中所涉及的化学工业 (写出两个即可)。
(2)反应I需在500℃进行,主要原因是 ;实际工业生产中,反应Ⅱ的条件是 。
(3)写出反应III的化学方程式 。
(4)工业上,析出K后,再向母液中继续通入E,并加入细小食盐颗料,其目的是 。
(5)工业上常用Na2CO3溶液吸收制取HNO3产生的尾气中的NO2,生成NaNO3、NaNO2和一种气体,写出反应的化学方程式 。
(1)合成氨,氨氧化法制硝酸,联合制碱法(或侯氏制减法)
(2)500℃时,该反应的催化剂的活性最高;铂铑合金作催化剂,高温
(3)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(4)增大NH4+和Cl-的浓度,析出副产品NH4Cl
(5)2NO2+Na2CO3=NaNO3+NaNO2+CO2
解析

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案下列有关工业生产的叙述正确的是
| A.合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好 |
| B.硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C.电解精炼铜时,精铜作阴极 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: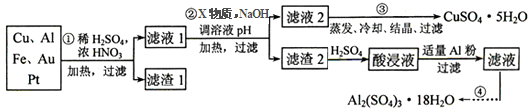
按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。 2013年诺贝尔化学奖授予美国科学家马丁·卡普拉斯、迈克尔·莱维特、阿里耶·瓦谢勒,以表彰他们“在开发多尺度复杂化学系统模型方面所做的贡献”。这种用电脑取代木棒作试验模型,催生了现代化学研究手段的一次新飞跃。下列不属于现代化学对物质结构进行研究的手段的是( )
| A.X射线 | B.天平 | C.质谱 | D.核磁共振 |
1999年度诺贝尔化学奖授予了开创“飞秒(10-15s)化学”新领域的科学家,使运用激光光谱技术观测化学反应时分子中原子运动成为可能。你认为该技术不能观察到的是
| A.原子中原子核的内部结构 | B.化学反应中原子的运动 |
| C.化学反应中生成物分子的形成 | D.化学反应中反应物分子的分解 |