题目内容
(15分)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知
CH3OH(1) + O2(g) =" CO(g)" + 2H2O(g) ; △Ha = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ; △Hb =-566.0 kJ·mol-1
(1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
(2)甲醇作为燃料,它的优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用(1)中的热化学方程式计算,完全燃烧20g甲醇,生成二氧化碳和水蒸汽时,放出的热量为 kJ ,生成的CO2气体标准状况下体积是 L
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在 极反应;电极反应式为 。
(4)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
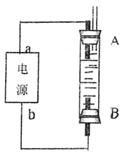
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化是 ,反应的化学方程式为 。
CH3OH(1) + O2(g) =" CO(g)" + 2H2O(g) ; △Ha = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ; △Hb =-566.0 kJ·mol-1
(1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
(2)甲醇作为燃料,它的优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用(1)中的热化学方程式计算,完全燃烧20g甲醇,生成二氧化碳和水蒸汽时,放出的热量为 kJ ,生成的CO2气体标准状况下体积是 L
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在 极反应;电极反应式为 。
(4)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)

A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化是 ,反应的化学方程式为 。
(15分)(1)2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g);△H =-1453.28kJ·mol-1
(2)454.15; 14
(3)负; CH3OH + 8OH--6e-= CO32-+ 6H2O
( 4)B、D ;白色沉淀迅
4)B、D ;白色沉淀迅 速变成灰绿色,最终变成红褐色;
速变成灰绿色,最终变成红褐色;
4Fe (OH)2+ O2+ 2H2O = 4Fe (OH)3
(2)454.15; 14
(3)负; CH3OH + 8OH--6e-= CO32-+ 6H2O
(
 4)B、D ;白色沉淀迅
4)B、D ;白色沉淀迅 速变成灰绿色,最终变成红褐色;
速变成灰绿色,最终变成红褐色;4Fe (OH)2+ O2+ 2H2O = 4Fe (OH)3
略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
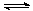 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
 CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol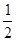 O2(g) = H2O(g) ΔH1=a kJ·mol-1
O2(g) = H2O(g) ΔH1=a kJ·mol-1 8K时的热化学反应方程式:(3分)
8K时的热化学反应方程式:(3分)