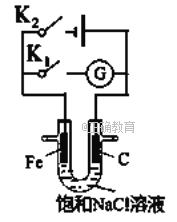
��Ŀ����
����Ŀ��X��Y��Z��W���ֶ�����Ԫ�������ڱ��е�λ�ù�ϵ��ͼ����YԪ��ԭ�ӵ������������ǵ��Ӳ�����3����

��1�� W��ԭ�ӽṹʾ��ͼΪ_____________��
��2��һ�������£�X����ͼ��⻯����X��ij�������ﰴ2:3���ʵ����Ȼ��ǡ�÷�Ӧ����X���ʺ�ˮ����������Ļ�ѧʽΪ____________��
��3��д��ͭƬ����Z�����������ˮ����ϡ��Һ��û�����Ա仯�����ȣ���Ȼ��ʡ���ͨ���������Һ����������Ӧ�����ӷ���ʽ��____________��
II����Y��Z�ĺ��������֮��Ϊ20 ��
��4����Է�������Ϊ28 ��Y���⻯�����ʽΪ____________
��5��W��һ�ֵ�����������Ũ���ᣬ��Ӧ����ת�Ƶ������ʵ����Ǹõ��ʵ�20������Ӧ�Ļ�ѧ����ʽ��____________��
��6��X�����۵�2076�����е�3927�� ������Ӳ�Ƚ����ڽ��ʯ����X���ʾ�������_______���壻Z���ʾ���ṹ����ʯ���ƣ������ڻ�ѧ������Ϊ____________��
���𰸡���1��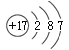 ��
��
��2��NO(��N2O)
��3��2Cu+4H++O2=2Cu2++2H2O��
��4��![]() ��
��
��5��P4+20HNO3(Ũ)=20NO2��+4H3PO4+4H2O��
��6��ԭ�ӣ�109��28��
�����������������YԪ��ԭ�ӵ������������ǵ��Ӳ�����3����YΪOԪ�أ�����X��Y��Z��W���ֶ�����Ԫ�������ڱ��е�λ�ù�ϵ��XΪNԪ�أ�ZΪSԪ�أ�WΪClԪ�ء�
��1�� ClԪ����17��Ԫ�أ�ԭ�ӽṹʾ��ͼΪ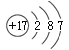 ���ʴ�Ϊ��
���ʴ�Ϊ��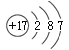 ��
��
��2��X����ͼ��⻯����NH3��N�Ļ��ϼ�Ϊ-3�ۣ���X��ij�������ﰴ2:3���ʵ����Ȼ��ǡ�÷�Ӧ����X���ʺ�ˮ�����ݻ��ϼ������غ㣬����������N�Ļ��ϼ�Ϊ+2�ۣ���ѧʽΪNO���ʴ�Ϊ��NO��
��3������ʱͨ�������ͭ�������е��������������ɵ�����ͭ�������ܽ⣬��Һ����������Ӧ�����ӷ���ʽΪ2Cu+4H++O2=2Cu2++2H2O���ʴ�Ϊ��2Cu+4H++O2=2Cu2++2H2O��
II��Z�ĺ����������Y��8����Y��Z�ĺ��������֮��Ϊ20����Y�ĺ��������Ϊ6����YΪCԪ�أ�ZΪSiԪ�ء�WΪPԪ�أ�XΪBԪ�ء�
��4����Է�������Ϊ28 ��Y���⻯��Ļ�ѧʽΪC2H4������ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��5��P��һ�ֵ���������Ũ���ᷴӦ�����ɶ���������P������Ϊ���ᣬ1molPԭ�ӱ�������ת�Ƶ���5mol������Ӧ����ת�Ƶ������ʵ���Ϊ20mol�����������ʵ���Ϊ1mol����4molPԭ�ӣ��õ��ʵĻ�ѧʽΪP4����Ӧ�Ļ�ѧ����ʽΪP4+20HNO3(Ũ)=20NO2��+4H3PO4+4H2O���ʴ�Ϊ��P4+20HNO3(Ũ)=20NO2��+4H3PO4+4H2O��
��6���������ʵ��������ʣ��۵�2076�����е�3927�� ������Ӳ�Ƚ����ڽ��ʯ����������ԭ�Ӿ��壻�辧��ṹ����ʯ���ƣ������ڻ�ѧ������Ϊ109��28�����ʴ�Ϊ��ԭ�ӣ�109��28����