题目内容
【题目】某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
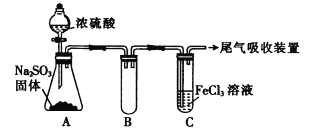
(1) 反应开始一段时间后,装置C中的现象为__________。
(2) 根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
① 写出SO2与FeCl3溶液反应的离子方程式:____________。
② 向装置C中通入足量SO2发生反应后,检验生成的Fe2+的方法是__________。
③该小组同学向反应后的装置C的试管中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,则证明反应生成了SO42-。该做法不合理的理由是__________________。
(3)若将装置C中FeCl3溶液更换为Fe(NO3)3和BaCl2的混合液,可观察到装置C中出现白色沉淀,该小组对装置C中产生沉淀的原因提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置C中参与反应。
假设2: _______________________。
假设3:在酸性条件下NO3-能氧化SO2。
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
① ② ③ |
【答案】
(1)溶液由棕黄色变为浅绿色;
(2)①2Fe3+ +SO2 +2H2O =SO42- +4H+ +2Fe2+ ;
②取少量反应后的溶液于试管中,向其中滴人KSCN溶液,不变红,再滴加适量新制的氯水(或H2O2溶液等),溶液变红;
③硝酸可以将溶解的SO2氧化为H2SO4,干扰实验;
(3)SO2被 Fe3+氧化为SO42- ;
(4)
实验步骤(简述操作过程) | 预期现象和结论 |
①取适量Ba(NO3)2溶液于试管中; ②向试管中通入过量SO2气体; ③再向试管中加入过量盐酸 | 若先有白色沉淀生成,加入盐酸后沉淀不消失,则假设3成立 |
【解析】
试题分析:(1)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色,故答案为:溶液由棕黄色变为浅绿色;
(2)①发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3++SO2+2H2O=SO42-+4H++2Fe2+,故答案为:2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
②检验有Fe2+生成的实验方法为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红,故答案为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验,故做法不合理,故答案为:不合理;硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验;
(3)假设1:装置A中白雾进入装置C中参与反应。假设2: SO2被Fe3+氧化了生成了SO42-。假设3:在酸性条件下NO3-能氧化SO2。故答案为:SO2被Fe3+氧化了生成了SO42-;
(4)假如SO2与NO3-反应,则可设计如下实验进行验证:①取适量Ba(NO3)2溶液于试管中;②向试管中通入过量SO2气体;③再向试管中加入过量盐酸,若先有白色沉淀生成,加入盐酸后沉淀不消失,则假设3成立,故答案为:
实验步骤(简述操作过程) | 预期现象和结论 |
①取适量Ba(NO3)2溶液于试管中; ②向试管中通入过量SO2气体; ③再向试管中加入过量盐酸 | 若先有白色沉淀生成,加入盐酸后沉淀不消失,则假设3成立 |

 阅读快车系列答案
阅读快车系列答案