题目内容
【题目】甲醇(CH3OH)是一种优质燃料,(1)已知一定条件下88gCO2和足量氢气完全反应可生成气态甲醇(CH3OH)和水蒸汽并放出98kJ的热量。 请回答:
(1)该反应的热化学方程式: __________________________________________。
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图。请回答:
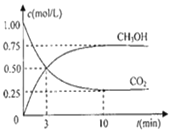
①从反应开始到平衡,氢气的反应速率:υ(H2)=______。
②下列措施中能使υ(CO2)增大的是______。
A 加入催化剂 B 充入He(g),使体系压强增大
C 将H2O(g)从体系中分离 D 升高温度
③能够说明该反应已达到平衡的是______。
A 恒温、恒容时,容器内的压强不再变化 B 恒温、恒容时,容器内混合气体的密度不再变化 C 一定条件下,CO2、H2和CH3OH的浓度不再变化 D 一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH E 有2个C=O键断裂的同时,有3个H-H键断裂
(3)甲醇—空气碱性燃料电池在生活中有着广泛的应用,写出该电池正极的电极反应式_____________。
【答案】CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=﹣49.0kJ/mol 0.225 molL-1min-1 AD AC O2+2H2O+4e-=4OH-
【解析】
(1)根据n=m/M,计算88gCO2和氢气化合生成甲醇和水放出的热量,结合热化学方程式书写方法标注物质聚集状态和反应焓变写出;
(2)①υ=△c/△t和同一化学反应中不同物质表示的化学反应速率之比等于计量数之比,求反应速率;
②根据升高温度,增大浓度,增大压强,加入催化剂等可以加快反应速率判断如何增加CO2的反应速率;
③可逆反应达到平衡状态时,同种物质的正逆反应速率相等,用不同的物质表示正逆反应速率时等于计量数之比;平衡时,各物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变。
(3)甲醇燃料电池中,正极O2发生得电子的还原反应。
(1)88gCO2的物质的量为2mol,2molCO2完全反应可以放出98kJ的热量。根据原子守恒,配平化学方程式,CO2(g)+3H2(g)=CH3OH(g)+H2O(g),化学方程式中为1molCO2参加反应完全反应时放出的热量为49kJ。热化学方程式需要标准物质的状态,以及焓变,热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=﹣49.0kJ/mol;
(2)①根据图示,从反应到平衡时,CO2的浓度从1mol·L-1降低到0.25mol·L-1,共用时10min。根据υ(CO2)=![]() ;同一化学反应中,不同物质表示的化学反应速率之比等于化学计量数之比,则有υ(CO2):υ(H2)=1:3,可得υ(H2)=0.225mol·L-1·min-1。
;同一化学反应中,不同物质表示的化学反应速率之比等于化学计量数之比,则有υ(CO2):υ(H2)=1:3,可得υ(H2)=0.225mol·L-1·min-1。
②A.加入催化剂,可以降低反应活化能,增大化学反应速率,A符合题意;
B.充入He,虽然体系的压强增大,但是CO2的浓度不变,化学反应速率不变;B项不符合题意;
C.将H2O从体系中分离的瞬间,CO2的浓度不变,CO2的速率不变;C项不符合题意;D.升高温度,化学反应速率增大,D项符合题意;
答案为AD;
③A.恒温恒容时,压强之比等于物质的量之比,反应前后物质的量发生改变,则压强发生改变,当压强不变的时候,说明各物质的物质的量不变,反应达到了平衡;A项符合题意;
B.![]() ,各反应物均为气体,m总不变,恒容容器,V不变,说明密度一直不变,密度不变不能说明反应达到了平衡;B项不符合题意;
,各反应物均为气体,m总不变,恒容容器,V不变,说明密度一直不变,密度不变不能说明反应达到了平衡;B项不符合题意;
C.达到平衡状态时,各物质消耗的速率和生成的速率相等,所以各物质的浓度不再发生变化,C项符合题意;
D.消耗H2为正反应速率,生成甲醇也是正反应速率,无法得知正逆反应是否相等,无法得知是否平衡;D项不符合题意;
E.C=O键断开,表示的为正反应速率,H-H键断开也表示正反应速率,无法得知正逆反应是否相等,无法得知是否平衡;E项不符合题意;
答案为AC;
(3)甲醇-空气燃料电池,正极的反应物为O2。电解质溶液为碱性,氧气得到电子和水反生生成OH-,电极方程式为O2+2H2O+4e-=4OH-。