题目内容
【题目】某化学兴趣小组欲用下列装置制备氯水并探究其性质。完成下列填空:
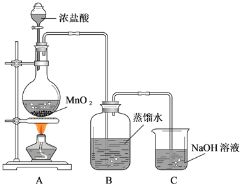
(1)C 装置的作用是________________。
(2)氯水制备完成后,甲同学从B中取出一定量的样品置于日光下照射一段时间,发现样品某些性质发生了明显的变化,请各列举一项:
物理性质变化:________________;
化学性质变化:________________。
(3)为证明氯气与水反应产物具有漂白性,丁同学将A中产生的气体缓缓通过下列装置:

试剂 a 应选择_____; 试剂 b 应选择_____。
(4)戊同学从B中取出少量样品,滴到 NaHCO3 粉末上,有无色气泡产生,由此他认为氯气与水反应至少产生一种酸性强于碳酸的物质。请评价他的观点是否正确并说明理由 ________________。
【答案】吸收多余氯气 溶液颜色变浅 溶液酸性增强(或漂白性减弱等) CaCl2 碱石灰 不正确,因为A中会挥发出HCl进入B中,使溶液中存在盐酸。
【解析】
用MnO2与浓盐酸在加热条件下反应制Cl2,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;制得的Cl2通入水中,将制得氯水,呈黄绿色,里面含有Cl2、HCl、HClO等,由于浓盐酸能挥发出HCl随Cl2一起逸出,所以氯水中的HCl有一部分来自盐酸;HCl具有酸性,HClO具有漂白性,但见光易分解,应避光保存;但Cl2本身没有漂白性。
MnCl2+Cl2↑+2H2O;制得的Cl2通入水中,将制得氯水,呈黄绿色,里面含有Cl2、HCl、HClO等,由于浓盐酸能挥发出HCl随Cl2一起逸出,所以氯水中的HCl有一部分来自盐酸;HCl具有酸性,HClO具有漂白性,但见光易分解,应避光保存;但Cl2本身没有漂白性。
(1)氯气是大气污染物,需进行处理,由此得出C 装置的作用是吸收多余氯气,防止污染环境。答案为:吸收多余氯气;
(2)光照后,氯水中HClO不断分解,促使Cl2不断与水反应,若时间足够长,最后氯水变为稀盐酸。物理性质变化:溶液颜色变浅;
化学性质变化:溶液酸性增强(或漂白性减弱等)。答案为:溶液颜色变浅;溶液酸性增强(或漂白性减弱等);
(3)从图中可能看出,试剂a的作用是吸收水蒸气,且呈固态,所以试剂 a 应选择无水CaCl2;试剂 b 应能吸收Cl2,所以应选择碱石灰。答案为:CaCl2;碱石灰;
(4)前面已经分析,HCl不仅可以来自Cl2与水的反应,还可来自盐酸挥发出的HCl。戊同学的观点不正确,因为A中会挥发出HCl进入B中,使溶液中存在盐酸。答案为:不正确,因为A中会挥发出HCl进入B中,使溶液中存在盐酸。