题目内容
NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
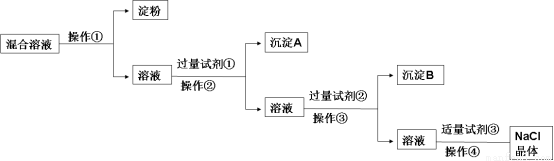
(1)写出上述实验过程中所用试剂(写化学式):
试剂①_______________________;试剂③________________________。
(2)判断试剂①已过量的方法是:________________________________________。
(3)用化学方程式表示加入试剂②的作用:
(4)操作①是利用半透膜进行分离提纯。
操作①的实验结果:淀粉 (填“能”或“不能”)透过半透膜;
SO42- (填“能”或“不能”)透过半透膜;
请用实验证明上述结果,完成下表(可不填满,也可增加):
限选试剂:1mol/L AgNO3溶液、1mol/L BaCl2溶液、1mol/L Ba(NO3)2溶液、
碘水、稀盐酸、稀硝酸
编号 | 实验操作 | 预期现象和结论 |
① |
|
|
② |
|
|
|
|
|
(1)BaCl2(2分);HCl(2分)(2)静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量。(2分)
(3)BaCl2+Na2CO3=2NaCl+BaCO3↓ CaCl2+Na2CO3=2NaCl+CaCO3↓(每方程式2分,共4分))
(4)不能(1分); 能(1分); 填表(共8分)
编号 | 实验操作 | 预期现象和结论 |
① | 取半透膜外液体,加入少量碘水(2分) | 液体没有变成蓝色,证明淀粉不能透过半透膜(2分) |
② | 另取半透膜外液体,加入足量稀盐酸和少量1mol/L BaCl2溶液(2分) | 产生不溶于盐酸的白色沉淀,证明SO42-能够透过半透膜(2分) |
【解析】
试题分析:根据题给流程图分析:混合液先通过渗析分离出淀粉胶体,再向剩余溶液中加过量氯化钡溶液, 除去硫酸根,然后再加过量的碳酸钠溶液除去钙离子和过量的钡离子,过滤后向滤液中加适量盐酸,除去过量的碳酸钠,蒸发的氯化钠晶体。(1)根据上述分析知,试剂①为BaCl2;试剂③HCl。(2)判断氯化钡溶液已过量的方法是:静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量。(3)加过量的碳酸钠溶液目的是除去钙离子和过量的钡离子,反应的化学方程式为 BaCl2+Na2CO3=2NaCl+BaCO3↓ CaCl2+Na2CO3=2NaCl+CaCO3↓。(4)利用溶液中小的分子或离子能透过半透膜,胶体微粒不能透过半透膜,采用渗析的方法将二者分离,然后再分别用碘单质检验淀粉,用盐酸和氯化钡溶液检验硫酸根;实验方案见答案。
考点:考查物质的分离和提纯的基本操作。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案