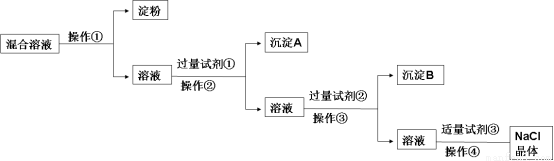
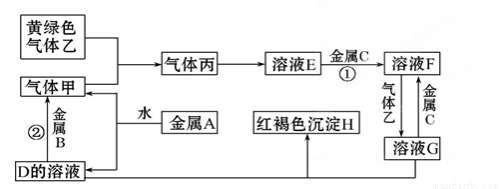
题目内容
将0.1 mol的MnO2和40 mL 10 mol·L-1的浓盐酸混合后加热,充分反应后,向所得溶液中加入足量的AgNO3溶液。在此过程中:
(1)产生的Cl2在标准状况下的体积V(Cl2)为______(填写体积范围);
(2)产生的AgCl沉淀的物质的量为______ (假设盐酸不挥发,且产生的Cl2的物质的量为a mol)。
(1)0<V(Cl2)<2.24 L (2)(0.4-2a) mol
【解析】
试题分析:(1)浓盐酸的物质的量是0.04L×10mol/L=0.4mol,根据方程式MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑可知,理论上恰好与0.1mol二氧化锰恰好反应生成0.1mol氯气。但由于在反应过程中氯化氢被消耗以及挥发、溶剂水的增加均导致盐酸的浓度降低,而二氧化锰不能氧化稀盐酸,所以最终产生的氯气体积范围是0<V(Cl2)<2.24 L。
MnCl2+2H2O+Cl2↑可知,理论上恰好与0.1mol二氧化锰恰好反应生成0.1mol氯气。但由于在反应过程中氯化氢被消耗以及挥发、溶剂水的增加均导致盐酸的浓度降低,而二氧化锰不能氧化稀盐酸,所以最终产生的氯气体积范围是0<V(Cl2)<2.24 L。
(2)假设盐酸不挥发,且产生的Cl2的物质的量为a mol,则根据氯离子守恒可知,溶液中氯离子的物质的量=0.4mol-amol×2=(0.4-2a) mol。根据方程式Ag++Cl-=AgCl↓可知,生成氯化银的物质的量=(0.4-2a) mol。
考点:考查二氧化锰与浓盐酸反应制备氯气的有关判断和计算

练习册系列答案
相关题目