题目内容
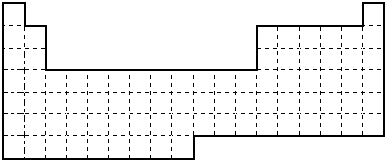
X、Y、V、W是常见的短周期元素,它们在周期表里的位置如下图所示.V、W的最简单的气态氢化物M、N混合时有白烟生成,M是碱性气体.请回答以下问题:
(1)W的原子结构示意图为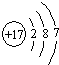
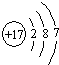 .
.
(2)常温常压下,将a L M气体和b L N气体通入水中,若所得溶液的pH=7,则a
(3)二氧化钛(TiO2)与X的单质、Y的单质在高温下反应,生成由两种元素组成的两种化合物,该反应的化学方程式为
(4)联氨(N2H4)也叫肼,是火箭的燃料写出肼的结构式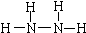
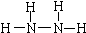 ,用次氯酸钠溶液氧化M能得到肼的稀溶液,写出反应的离子方程式
,用次氯酸钠溶液氧化M能得到肼的稀溶液,写出反应的离子方程式
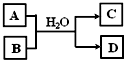
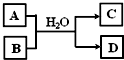
(5)含X元素的一种化合物A与Y的最高价氧化物B之间有右图的转化关系,若D为白色沉淀,则如图转化的离子方程式为
| Y | V | |||
| X | W |
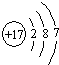
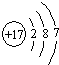
(2)常温常压下,将a L M气体和b L N气体通入水中,若所得溶液的pH=7,则a
>
>
b(填“>、=、<”)(3)二氧化钛(TiO2)与X的单质、Y的单质在高温下反应,生成由两种元素组成的两种化合物,该反应的化学方程式为
3TiO2+4Al+3C
2Al2O3+3TiC
| ||
3TiO2+4Al+3C
2Al2O3+3TiC
.
| ||
(4)联氨(N2H4)也叫肼,是火箭的燃料写出肼的结构式
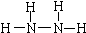
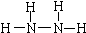
ClO-+2NH3=N2H4+Cl-+H2O
ClO-+2NH3=N2H4+Cl-+H2O
.(5)含X元素的一种化合物A与Y的最高价氧化物B之间有右图的转化关系,若D为白色沉淀,则如图转化的离子方程式为
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
. 
分析:V、W的最简单的气态氢化物M、N混合时有白烟生成,M是碱性气体,则M为NH3,N为HCl,所以V为N元素,W为Cl元素,根据四种元素在周期表中的位置可知,Y为C元素,X为Al元素,
(1)W为Cl元素,原子序数为17,原子核外有3个电子层,最外层电子数为7;
(2)根据NH4Cl为强酸弱碱盐分析;
(3)Y为C元素,X为Al元素,与二氧化钛(TiO2)在高温下反应生成的两种化合物为Al2O3和TiC,根据反应物结合质量守恒定律书写化学方程式;
(4)联氨(N2H4)中N原子与其它三个原子成键,达到8电子稳定结构,结构式为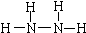 ,根据反应物和生成物书写反应的离子方程式;
,根据反应物和生成物书写反应的离子方程式;
(5)含X元素的一种化合物A与Y的最高价氧化物B(CO2)之间发生反应,生成白色沉淀D为Al(OH)3.
(1)W为Cl元素,原子序数为17,原子核外有3个电子层,最外层电子数为7;
(2)根据NH4Cl为强酸弱碱盐分析;
(3)Y为C元素,X为Al元素,与二氧化钛(TiO2)在高温下反应生成的两种化合物为Al2O3和TiC,根据反应物结合质量守恒定律书写化学方程式;
(4)联氨(N2H4)中N原子与其它三个原子成键,达到8电子稳定结构,结构式为
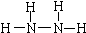 ,根据反应物和生成物书写反应的离子方程式;
,根据反应物和生成物书写反应的离子方程式;(5)含X元素的一种化合物A与Y的最高价氧化物B(CO2)之间发生反应,生成白色沉淀D为Al(OH)3.
解答:解:V、W的最简单的气态氢化物M、N混合时有白烟生成,M是碱性气体,则M为NH3,N为HCl,所以V为N元素,W为Cl元素,根据四种元素在周期表中的位置可知,Y为C元素,X为Al元素,则
(1)W为Cl元素,原子序数为17,原子核外有3个电子层,最外层电子数为7,则原子结构示意图为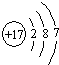 ,
,
故答案为: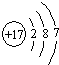 ;
;
(2)M为NH3,N为HCl,如二者等物质的量混合物,则恰好反应生成NH4Cl,为强酸弱碱盐,溶液呈酸性,若所得溶液的pH=7,氨气应过量,故答案为:>;
(3)Y为C元素,X为Al元素,与二氧化钛(TiO2)在高温下反应生成的两种化合物为Al2O3和TiC,反应的化学方程式为3TiO2+4Al+3C
2Al2O3+3TiC,
故答案为:3TiO2+4Al+3C
2Al2O3+3TiC;
(4)联氨(N2H4)中N原子与其它三个原子成键,达到8电子稳定结构,结构式为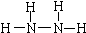 ,次氯酸钠溶液氧化NH3能得到肼的离子方程式为ClO-+2NH3=N2H4+Cl-+H2O,
,次氯酸钠溶液氧化NH3能得到肼的离子方程式为ClO-+2NH3=N2H4+Cl-+H2O,
故答案为: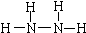 ;ClO-+2NH3=N2H4+Cl-+H2O;
;ClO-+2NH3=N2H4+Cl-+H2O;
(5)含X元素的一种化合物A与Y的最高价氧化物B(CO2)之间发生反应,生成白色沉淀D为Al(OH)3,为AlO2-溶液与CO2的反应,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(1)W为Cl元素,原子序数为17,原子核外有3个电子层,最外层电子数为7,则原子结构示意图为
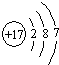 ,
,故答案为:
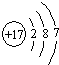 ;
;(2)M为NH3,N为HCl,如二者等物质的量混合物,则恰好反应生成NH4Cl,为强酸弱碱盐,溶液呈酸性,若所得溶液的pH=7,氨气应过量,故答案为:>;
(3)Y为C元素,X为Al元素,与二氧化钛(TiO2)在高温下反应生成的两种化合物为Al2O3和TiC,反应的化学方程式为3TiO2+4Al+3C
| ||
故答案为:3TiO2+4Al+3C
| ||
(4)联氨(N2H4)中N原子与其它三个原子成键,达到8电子稳定结构,结构式为
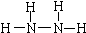 ,次氯酸钠溶液氧化NH3能得到肼的离子方程式为ClO-+2NH3=N2H4+Cl-+H2O,
,次氯酸钠溶液氧化NH3能得到肼的离子方程式为ClO-+2NH3=N2H4+Cl-+H2O,故答案为:
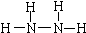 ;ClO-+2NH3=N2H4+Cl-+H2O;
;ClO-+2NH3=N2H4+Cl-+H2O;(5)含X元素的一种化合物A与Y的最高价氧化物B(CO2)之间发生反应,生成白色沉淀D为Al(OH)3,为AlO2-溶液与CO2的反应,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
点评:本题考查元素推断以及元素化合物的性质,题目难度中等,本题从元素对应的单质、化合物的性质入手结合元素在周期表中的相对位置推断,学习中注重元素化合物知识的积累.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目