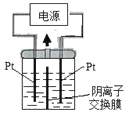
题目内容
【题目】按要求完成下列各题:
(1)画出Li2O的电子式________________________
(2)用电子式表示CO2分子的形成过程_________________________________________
(3)画出N2分子的结构式_________________
(4)写出全部是由H、O、S、K四种元素形成的两种盐相互反应的离子方程式__________
(5)第3周期的两种金属氧化物对应的水化物间能相互发生反应,写出其化学反应方程式_____________
(6)如图是元素周期表的一个方格  ,其中19.00的意义是___________
,其中19.00的意义是___________
【答案】![]()
![]() N
N![]() N H++HSO3-=SO2↑+H2O NaOH+Al(OH)3=Na[Al(OH)4] F元素的相对原子质量
N H++HSO3-=SO2↑+H2O NaOH+Al(OH)3=Na[Al(OH)4] F元素的相对原子质量
【解析】
(1)Li2O是离子化合物,含有离子键,电子式为![]() ;
;
(2)CO2分子是共价化合物,含有极性键,其形成过程为![]() ;
;
(3)氮气分子中含有氮氮三键,结构式为N![]() N;
N;
(4)全部是由H、O、S、K四种元素形成的两种盐相互反应,这说明是硫酸氢钾和亚硫酸氢钾,二者反应的离子方程式为H++HSO3-=SO2↑+H2O;
(5)第3周期的两种金属氧化物对应的水化物间能相互发生反应,说明含有两性氢氧化物,因此只能是氢氧化钠和氢氧化铝,反应的化学方程式为NaOH+Al(OH)3=Na[Al(OH)4];
(6)根据方格 可判断其中19.00表示F元素的相对原子质量。
可判断其中19.00表示F元素的相对原子质量。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目