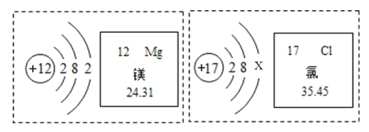
题目内容
【题目】用“![]() ”或“
”或“![]() ”回答下列问题
”回答下列问题
①元素的非金属性越强,其对应最高价氧化物水化物的酸性越______;
②元素的金属性越强,其对应最高价氧化物水化物的碱性越______;
③元素的______性越强,其对应气态氢化物的稳定性越______;
④酸性:![]() ______
______![]() ;气态氢化物稳定性:
;气态氢化物稳定性:![]() ______HCl。
______HCl。
【答案】强 强 非金属 强 ![]()
![]()
【解析】
根据元素非金属性和金属性强弱的判断方法分析解答。
①元素的非金属性越强,其对应最高氧化物水化物的酸电离氢离子越容易,导致其最高价氧化物的水化物酸性越强,故答案为:强;
②元素的金属性越强,其对应最高氧化物水化物的碱电离出氢氧根离子越容易,所以碱性越强,故答案为:强;
③元素的非金属性越强,其对应气态氢化物中非金属元素吸引电子能力越强,导致其氢化物的稳定性越强,故答案为:非金属;强;
④元素的非金属性越强,其最高价氧化物的水化物酸性越强,氢化物的稳定性越强,非金属性Si<P、S<Cl,所以酸性:H2SiO3<H3PO4;气态氢化物稳定性:H2S<HCl,故答案为:<;<。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验中的颜色变化,与氧化还原反应无关的是( )
选项 | 实验操作 | 现象 |
A | AgNO3溶液滴入氯水中 | 产生白色沉淀,随后淡黄绿色逐渐褪去 |
B | FeCl3溶液滴入Mg(OH)2浊液中 | 白色浑浊转化为红褐色沉淀 |
C | H2C2O4溶液滴入KMnO4酸性溶液中 | 产生气泡,随后紫色褪去 |
D | Na块放在坩埚里并加热 | 发出黄色火焰,生成淡黄色固体 |
A.AB.BC.CD.D
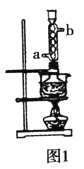
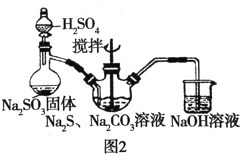
【题目】某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的: ______
(2)实验用品:药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
仪器:① ______ ;② ______ ![]() 请填写两件主要的玻璃仪器
请填写两件主要的玻璃仪器![]()
(3)实验内容:
序号 | 实验方案 | 实验现象 |
① | 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层 |
② | 将少量溴水滴入盛有少量KI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层 |
(4)实验结论: ______ .
(5)问题和讨论:请用结构理论简单说明得出上述结论的原因. ______ .