题目内容
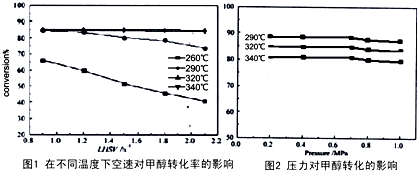
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) 3Z(g)? △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)? △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是

A.升高温度,平衡常数增大?????????????
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
C
【解析】
试题分析:A、?H< 0,该反应为放热反应,升高温度,平衡常数减小,错误;B、温度越高,化学反应速率越大,所以W点X的正反应速率小于M点X的正反应速率,错误;C、Q点时,X的体积分数最小,则Y的转化率最大,正确;D、因为该反应气体系数不变,所以平衡时充入Z,新平衡与原平衡等效,Z的体积分数不变,错误。
考点:本题考查化学平衡移动、化学反应速率、图像的分析。

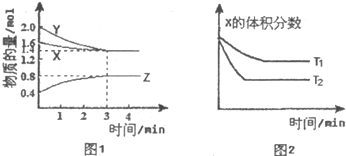
| A、容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | B、3min内,用Y表示的反应速率v(Y)=0.2mol/(L?min) | C、保持其他条件不变,升髙温度,化学平衡常数K增大 | D、保持其他条件不变,平衡后,增大体系压强,正反应速率增大,逆反应速率减小 |
一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)  4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
| A.10min时,反应达到平衡 |
| B.该温度下反应的平衡常数为8 |
| C.0~20min内平均反应速率v(N2O5)=0.05mol?L-1?min-1 |
| D.曲线a表示NO2的物质的量随反应时间的变化 |
氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)
 4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将___(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L—1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为______________。
③一定温度下,在2L恒容密闭容器中加入2mol
N2O5,达到平衡时,气体的压强为原来的 ,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
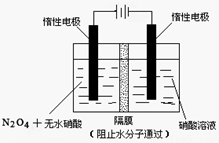
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的__________区生成,其电极反应式为_________________________________。
(3)如图:V(NO):V(O2)=3:1。当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态)。当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm。假设温度不变,且隔板及U形毛细管的体积都忽略不计,此时混合气体的平均相对分子质量为__________。