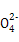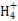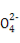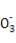جâؤ؟ؤعبف
ؤ³؟خحâ»î¶¯ذ،×éسûہûسأCuOسëNH3·´س¦,رذ¾؟NH3µؤؤ³ضضذشضت²¢²â¶¨ئن×é³ة,ةè¼ئءثبçدآتµرé×°ضأ£¨¼ذ³ض×°ضأخ´»³ِ£©½ّذذتµرé،£اë»ط´ًدآءذختجâ:
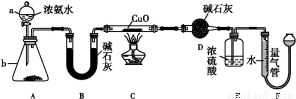
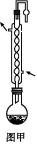
£¨1£©زائ÷aµؤأû³ئخھ،،،،،،،،;زائ÷bضذ؟ةر،شٌµؤتش¼ءخھ،،،،،،،،،£
£¨2£©تµرéتزضذ,ہûسأ×°ضأA,»¹؟ةضئب،µؤخقة«ئّجهتا،،،،،،،، £¨جî×ضؤ¸£©،£
A.Cl2،،،،،،،،B.O2،،،،،،،،C.CO2،،،،،،،،D.NO2
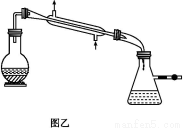
£¨3£©تµرéضذ¹غ²ىµ½×°ضأCضذ؛عة«CuO·غؤ©±نخھ؛ىة«¹ججه,ء؟ئّ¹ـسذخقة«خقخ¶µؤئّجه²ْةْ,ةدتِدضدَض¤أ÷NH3¾كسذ،،،،،،،،ذش,ذ´³ِدàس¦µؤ»¯ر§·½³جت½:،، ،£
£¨4£©E×°ضأضذإ¨ءٍثلµؤ×÷سأتا،، ،£
£¨5£©¶ءب،ئّجهجه»ا°,س¦¶ش×°ضأF½ّذذµؤ²ظ×÷: ،،،£
£¨6£©تµرéحê±د,بô²âµأ¸ةشï¹ـDشِضطm g,×°ضأF²âµأئّجهµؤجه»خھn L£¨زرصغثم³ة±ê×¼×´؟ِ£©,شٍ°±·ض×سضذµھ،¢اâµؤش×س¸ِت±بخھ،،،،،،،،£¨سأ؛¬m،¢n×ضؤ¸µؤ´ْتت½±يت¾£©،£
£¨1£©·ضز؛آ©¶·£¨2·ض£©،،رُ»¯¸ئ»ٍاâرُ»¯ؤئ¹ججه»ٍ¼îت¯»ز£¨2·ض£©
£¨2£©BC£¨1·ض£©،،£¨3£©»¹ش£¨2·ض£©،،3CuO+2NH3 3Cu+3H2O+N2£¨2·ض£©
3Cu+3H2O+N2£¨2·ض£©
£¨4£©خüتصخ´·´س¦µؤ°±ئّ,×èض¹Fضذث®صôئّ½ّبëD£¨2·ض£©
£¨5£©آآةددآزئ¶¯سز±كآ©¶·,ت¹×َسزء½¹ـز؛أودàئ½£¨2·ض£©
£¨6£©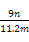 £¨1·ض£©
£¨1·ض£©
،¾½âخِ،؟£¨1£©زائ÷aتا·ضز؛آ©¶·,إ¨°±ث®؟ةزشسëةْت¯»ز،¢اâرُ»¯ؤئ¹ججه،¢¼îت¯»زµبضئب،°±ئّ،£
£¨2£©×°ضأAتاز»ضض¹ججه+ز؛جه·´س¦²»ذèزھ¼سببµؤئّجه·¢ةْ×°ضأ,؟ةزشسأہ´ضئب،H2،¢CO2،¢NO2µب,»¹؟ةزشسأH2O2سëMnO2ہ´ضئب،O2,صâہï×¢أ÷تاخقة«ئّجه,شٍ²»ؤـتاNO2،£
£¨3£©؛عة«CuO·غؤ©±نخھ؛ىة«¹ججه,ثµأ÷؛عة«µؤCuO±»»¹شخھCu,ح¬ت±NH3±»رُ»¯خھN2,ض¤أ÷ءثNH3¾كسذ»¹شذش:2NH3+3CuO 3Cu+N2+3H2O،£
3Cu+N2+3H2O،£
£¨4£©تµرéذèزھح¨¹³ئء؟D×°ضأ·´س¦ا°؛َµؤضتء؟²îہ´×÷خھ°±ئّضذاâش×سخïضتµؤء؟µؤ¼ئثمزہ¾ف,ثùزشE×°ضأ¾كسذ¸ôہëDسëFµؤ×÷سأ,·ہض¹Fضذµؤث®صôئّ½ّبëDضذ,ح¬ت±؟ةزش°رخ´·´س¦µؤNH3خüتصµô،£
£¨5£©²â¶¨ء؟ئّ¹ـتص¼¯ئّجهجه»ت±زھ±£ض¤×°ضأؤعئّجهر¹ا؟سë´َئّر¹دàµب,ثùزشذèزھتاء½¹ـز؛أودàئ½،£
£¨6£©DشِضطتاخüتصءثNH3»¹شCuOةْ³ةµؤث®µؤضتء؟,
n£¨H£©= ،ء2=
،ء2= mol,
mol,
n£¨N£©=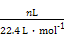 ،ء2=
،ء2=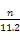 mol،£
mol،£
ثùزش°±·ض×سضذµھ،¢اâµؤش×س¸ِت±بخھ: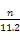 ،أ
،أ =
=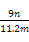 ،£
،£

 جىجىدٍةدز»±¾؛أ¾يدµءذ´ً°¸
جىجىدٍةدز»±¾؛أ¾يدµءذ´ً°¸ ذ،ر§ةْ10·ضضسس¦سأجâدµءذ´ً°¸
ذ،ر§ةْ10·ضضسس¦سأجâدµءذ´ً°¸دآ±يتا3ضضخïضتµؤبـ½â¶ب(20 ،و),دآءذثµ·¨ضذصب·µؤتا(،، ،،)
خïضت | MgCl2 | Mg(OH)2 | MgCO3 |
بـ½â¶ب(g/100 g) | 74 | 0.000 84 | 0.01 |
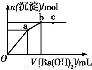
A.زرضھMgCO3µؤKsp=6.82،ء10-6,شٍثùسذ؛¬سذ¹ججهMgCO3µؤبـز؛ضذ,¶¼سذc(Mg2+)=c(C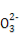 ),ازc(Mg2+)،¤c(C
),ازc(Mg2+)،¤c(C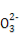 )=6.82،ء10-6
)=6.82،ء10-6
B.½«±يضذبضضخïضتسëث®»ى؛د,¼سبب،¢×ئةص,×îضصµؤ¹ججه²ْخïدàح¬
C.³ب¥´ضرخضذ؛¬سذµؤMgCl2شسضت,×î¼ر³شستش¼ءخھNa2CO3بـز؛
D.سأت¯»زث®´¦ہي؛¬سذMg2+؛حHC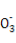 µؤس²ث®,·¢ةْµؤہë×س·´س¦·½³جت½خھMg2++2HC
µؤس²ث®,·¢ةْµؤہë×س·´س¦·½³جت½خھMg2++2HC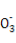 +Ca2++2OH-
+Ca2++2OH- CaCO3،+MgCO3،+2H2O
CaCO3،+MgCO3،+2H2O