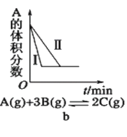
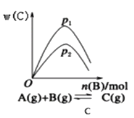
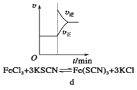
题目内容
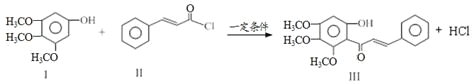
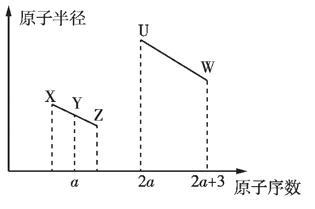
【题目】X、Y、Z、U、W五种短周期非金属元素的原子半径与原子序数有如图所示的关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是
A.XZ2与氢氧化钠溶液反应可能生成酸式盐
B.X、Y、Z形成的简单氢化物的稳定性逐渐减弱
C.U、X、W元素的最高价氧化物对应水化物的酸性依次增强
D.若元素T的原子序数大于U且与U同主族,则T的金属性强于U
【答案】B
【解析】
化合物XZ是水煤气的主要成分之一,则XZ为CO,根据原子半径X大于Z可知,X为C、Z为O,结合原子序数大小可知Y为N元素,a=7;U的原子序数是2a=14,则U为Si元素;W的原子序数=2a+3=17,为Cl元素,据此进行解答。
根据上述分析可知X是C,Y是N,Z是O,U是Si,W为Cl元素。
A. XZ2是CO2,该物质是酸性氧化物,少量CO2与NaOH溶液反应产生正盐Na2CO3,过量CO2与NaOH溶液反应产生酸式盐NaHCO3,A正确;
B. X是C,Y是N、Z是O,由于元素的非金属性C<N<O,元素的非金属性越强,其相应的氢化物的稳定性就越强,所以相应氢化物的稳定性:CH4<NH3<H2O,即X、Y、Z形成的简单氢化物的稳定性逐渐增强,B错误;
C. U是Si,X是C,W是Cl,元素的非金属性Cl>C>Si,元素的非金属性越强,其最高价氧化物对应水化物的酸性就越强,所以U、X、W元素的最高价氧化物对应水化物的酸性依次增强,C正确;
D. U为Si元素,T元素为与U同主族且在下一周期,则T为Ge元素,同一主族的元素,由上到下元素的金属性逐渐增强,所以元素的金属性T>U,D正确;
故合理选项是B。

 阅读快车系列答案
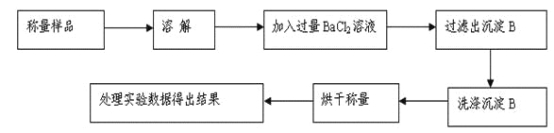
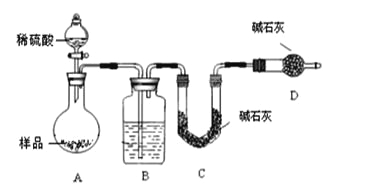
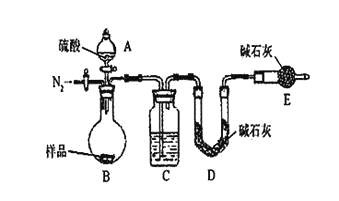
阅读快车系列答案【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
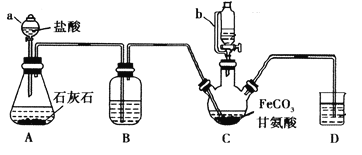
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。