题目内容
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl- 完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)为( )( mol·L-1)
| A.(y – 2x)/a | B.(y – x)/a | C.(2y – 2x)/a | D.(2y – 4x)/a |
D
解析试题分析:根据题意知,BaCl2和NaCl的混合溶液a L,将它均分成两份,一份滴加稀硫酸,发生的反应为:SO42-+Ba2+═BaSO4↓,使Ba2+完全沉淀,消耗xmolH2SO4,则溶液中钡离子的物质的量为xmol, c(Ba2+)=2x/amol/L,另一份滴加AgNO3溶液,发生的反应为: Ag++Cl-=AgCl↓,使Cl-完全沉淀,反应中消耗ymolAgNO3,则溶液中氯离子物质的量为ymol, c(Cl-)=2y/amol/L,根据溶液中的电荷守恒:2c(Ba2+)+ c(Na+)= c(Cl-)代入数据计算得c(Na+)=(2y – 4x)/amol/L,选D。
考点:考查混合物的有关计算、物质的量浓度的计算。

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述不正确的
| A.5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 NA |
| B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2 NA |
| C.50 mL 12 mol?L-1浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D.常温常压下,46 g NO2 与N2O4的混合气体中含有的原子总数为3 NA |
下列物质的电子式书写正确的是 ( )
A.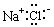 | B.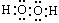 | C.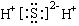 | D.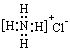 |
下列化学用语正确的是
A.HCl的电子式: |
| B.C-12原子: 12C |
| C.乙酸的结构简式:C2H4O2 |
| D.NH3?H2O的电离方程式:NH3?H2O→NH4++OH- |
下列有关化学用语表示正确的是
A.四氯化碳分子球棍模型:  |
| B.二氧化硅的分子式:SiO2 |
C.S2-离子结构示意图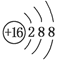 |
D.聚丙烯的结构简式: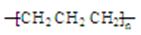 |
下列说法不正确的是
| A.K+与Ar的结构示意图相同 |
B.二氧化碳的电子式: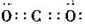 |
C.氧化钠的电子式: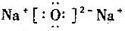 |
D.氯化氢的形成过程: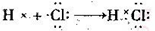 |
下列化学用语的书写正确的是
| A.乙醇的结构简式C2H6O | B.一氯甲烷的分子式CH3Cl |
C.硫原子的原子结构示意图 | D.四氯化碳的电子式 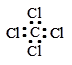 |
下列化学用语中,书写错误的是( )
A.硫离子的结构示意图: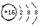 | B.氟化钠的电子式: |
C.甲基的电子式: | D.次氯酸的结构式:H―O―Cl |
用NA表示阿伏加德罗常数的值。下列叙述不正确的是
| A.标准状况下,33.6LCO2中含有氧原子数为3NA |
| B.1 mol OH-和1 mol -OH(羟基)所含质子数均为9NA |
| C.常温下,100mL 0.1 mol·L-1醋酸钠溶液中含醋酸根的数目小于0.01NA |
| D.50mL18.4 mol·L-1浓硫酸与足量铜加热反应,生成SO2分子数为0.46NA |