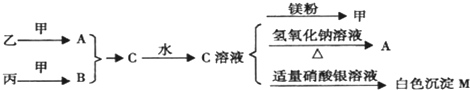
题目内容
在一定温度下,向容积固定不变的密闭容器中充入amolNO2,发生如下反应:
2NO2(g) N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
A.平均相对分子质量增大 B.NO2的转化率提高
C.NO2的质量分数增大 D.反应放出的总热量大于原来的2倍
【答案】
C
【解析】
试题分析:两平衡状态相比较发现,新平衡相当于在原平衡基础上压强增大1倍时达到的平衡,此时平衡正向移动。A、平衡右移,NO2的转化率增大,混合气体的物质的量减小、总的质量不变,则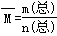 增大,正确;B、平衡右移,NO2的转化率增大,正确;C、平衡右移,NO2的转化率增大,混合气体的总的质量不变,NO2的质量分数减小,错误;D、由于平衡右移,容器中充入2amolNO2达到平衡时,反应的NO2比同容器中充入amolNO2达到平衡时反应的NO2的2倍还多,所以放出的总热量大于原来的2倍,正确。故选C。
增大,正确;B、平衡右移,NO2的转化率增大,正确;C、平衡右移,NO2的转化率增大,混合气体的总的质量不变,NO2的质量分数减小,错误;D、由于平衡右移,容器中充入2amolNO2达到平衡时,反应的NO2比同容器中充入amolNO2达到平衡时反应的NO2的2倍还多,所以放出的总热量大于原来的2倍,正确。故选C。
考点:考查化学平衡的影响因素和等效平衡的应用。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
在一定温度下,向容积为2L的密闭容器中充入一定量的CO和NO2发生反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0.有关该反应的描述正确的是( )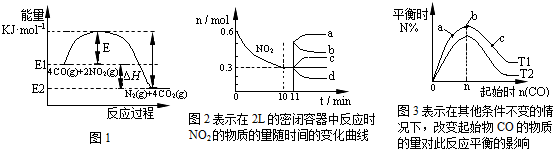

| A、在一定温度、固定容积的密闭容器里,混合气体的密度不再改变可以说明上述可逆反应已达平衡 | B、由图1可得加入适当的催化剂,E和△H都减小 | C、图2中0~10min内该反应的平均速率v(CO)=0.03mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(NO2)的变化曲线为d | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |