题目内容
盖斯定律指出了化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与其中间状态无关.按此规律,结合下述反应方程式回答问题:
①NH3(g)+HCl(g)═NH4Cl(s);△H=-176kJ/mol;②NH3(g)+H2O(l)═NH3?H2O(aq);△H=-35.1kJ/mol
③HCl(g)+H2O(l)═HCl(aq);△H=-72.3kJ/mol;④NH3?H2O(aq)+HCl(aq)═NH4Cl(aq);△H=-52.3kJ/mol
⑤NH4Cl(s)+2H2O(l)═NH4Cl(aq);△H=Q kJ/mol.则第⑤个反应方程中的反应热是
①NH3(g)+HCl(g)═NH4Cl(s);△H=-176kJ/mol;②NH3(g)+H2O(l)═NH3?H2O(aq);△H=-35.1kJ/mol
③HCl(g)+H2O(l)═HCl(aq);△H=-72.3kJ/mol;④NH3?H2O(aq)+HCl(aq)═NH4Cl(aq);△H=-52.3kJ/mol
⑤NH4Cl(s)+2H2O(l)═NH4Cl(aq);△H=Q kJ/mol.则第⑤个反应方程中的反应热是
+16.3 kJ/mol
+16.3 kJ/mol
.分析:根据盖斯定律可知,设计过程④+③+②-①可得⑤,第⑤个反应方程中的反应热由已知各热化学方程式中的反应热进行相应的数学运算得到.
解答:解:已知:①NH3(g)+HCl(g)═NH4Cl(s);△H=-176kJ/mol;
②NH3(g)+H2O(l)═NH3?H2O(aq);△H=-35.1kJ/mol
③HCl(g)+H2O(l)═HCl(aq);△H=-72.3kJ/mol;
④NH3?H2O(aq)+HCl(aq)═NH4Cl(aq);△H=-52.3kJ/mol
根据盖斯定律可知,④+③+②-①可得⑤NH4Cl(s)+2H2O(l)═NH4Cl(aq);故△H=-52.3 kJ/mol-72.3 kJ/mol-35.1 kJ/mol-(-176 kJ/mol)=+16.3 kJ/mol,
故答案为:+16.3 kJ/mol.
②NH3(g)+H2O(l)═NH3?H2O(aq);△H=-35.1kJ/mol
③HCl(g)+H2O(l)═HCl(aq);△H=-72.3kJ/mol;
④NH3?H2O(aq)+HCl(aq)═NH4Cl(aq);△H=-52.3kJ/mol
根据盖斯定律可知,④+③+②-①可得⑤NH4Cl(s)+2H2O(l)═NH4Cl(aq);故△H=-52.3 kJ/mol-72.3 kJ/mol-35.1 kJ/mol-(-176 kJ/mol)=+16.3 kJ/mol,
故答案为:+16.3 kJ/mol.
点评:本题考查盖斯定律的理解运用,难度中等,根据已知方程式构造目标方程式是关键.

练习册系列答案
相关题目
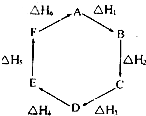 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,如图判断下列关系正确的是( )
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,如图判断下列关系正确的是( )| A、A→F,△H=-△H 6 | B、△H1+△H 2+△H 3+△H 4+△H 5+△H 6=1 | C、C→F,△H=△H 1+△H 2+△H 6 | D、△H 1+△H 2+△H 3═△H 4+△H5+△H 6 |
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )
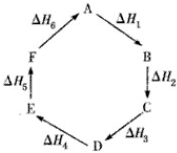

| A、C→F,|△H|=|△H1+△H2+△H6| | B、△H1+△H2+△H3+△H4+△H5+△H6=0 | C、A→F,△H=△H6 | D、|△H1+△H2+△H3|=|△H4+△H5+△H6| |
盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是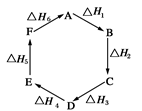
| A.A→F,ΔH=-ΔH6 |
| B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1 |
| C.C→F,|ΔH|=|ΔH1+ΔH2+ΔH6| |
| D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6| |
 盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关.物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )
盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关.物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )