题目内容
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是________(填元素符号),其中C原子的核外电子排布式为__________________。
(2)单质A有两种同素异形体,其中沸点高的是______(填分子式),原因是__________________________________________;A和B的氢化物所属的晶体类型分别为________和________。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为______________,中心原子的杂化轨道类型为________。
(4)化合物D2A的立体构型为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_______________________________________________。
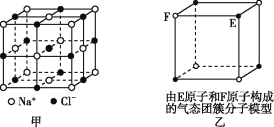
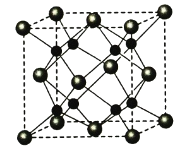
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为________;晶体F的密度(g·cm-3 )________________________________。(列出表达式)
【答案】O1s22s22p63s23p3O3相对分子质量越大,熔沸点越高分子晶体离子晶体三角锥形sp3V形2Cl2+Na2CO3=Cl2O↑+2NaCl+CO2↑Na2O![]()
【解析】
C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2﹣和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素。
(1)同周期自左而右电负性增大,Cl元素氧化物中氧元素表现负价,四种元素电负性最大的为O元素;C为P元素,原子核外电子数为15,根据能量最低原理原理书写核外电子排布式;(2)A为O元素,有O2、O3两种同素异形体,均属于分子晶体,相对原子质量越大,沸点越高;A、B的氢化物分别为H2O、NaH,前者为分子晶体、后者为离子晶体;(3)C和D生成组成比为1:3的化合物E为PCl3,计算P原子价层电子对数、孤电子对数,确定杂化方式与空间构型;(4)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×![]() +6×
+6×![]() =4,N(Na):N(O)=2:1,则形成的化合物为Na2O,由晶胞结构可知B原子配位数为4,计算晶胞质量和体积,可计算密度。
=4,N(Na):N(O)=2:1,则形成的化合物为Na2O,由晶胞结构可知B原子配位数为4,计算晶胞质量和体积,可计算密度。
(1)四种元素分别为O、Na、P、Cl,电负性最大的为O元素,C为P元素,核外电子排布为1s22s22p63s23p3。(2)A为O元素,有O2、O3两种同素异形体,二者对应的晶体都为分子晶体,因O3相对分子质量较大,则范德华力较大,沸点较高,A的氢化物为水,为分子晶体,B的氢化物为NaH,为离子晶体。(3)C和D反应可生成组成比为1:3的化合物为PCl3,P形成3个δ键,孤电子对数为![]() ,则P原子为sp3杂化,立体构型为为三角锥形;(4)化合物D2A为Cl2O,O为中心原子,形成2个δ键,孤电子对数为
,则P原子为sp3杂化,立体构型为为三角锥形;(4)化合物D2A为Cl2O,O为中心原子,形成2个δ键,孤电子对数为![]() ,则中心原子的价层电子对数为4,立体构型为V形;氯气与湿润的Na2CO3反应可制备Cl2O,反应的方程式为2Cl2+Na2CO3+H2O=Cl2O↑+2NaCl+CO2↑。(5)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×
,则中心原子的价层电子对数为4,立体构型为V形;氯气与湿润的Na2CO3反应可制备Cl2O,反应的方程式为2Cl2+Na2CO3+H2O=Cl2O↑+2NaCl+CO2↑。(5)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×![]() +6×
+6×![]() =4,N(Na):N(O)=2:1,则形成的化合物为Na2O;晶胞的质量为
=4,N(Na):N(O)=2:1,则形成的化合物为Na2O;晶胞的质量为![]() ,晶胞的体积为(0.566×10-7)3cm3,则晶体F的密度的计算式为
,晶胞的体积为(0.566×10-7)3cm3,则晶体F的密度的计算式为
![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列图示与对应的叙述不相符合的是

A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
【题目】下表中对应关系正确的是
A | CH3CH3+Cl2 | 均为取代反应 |
B | 由油脂得到甘油 | 均发生了水解反应 |
C | Cl2+2Br=2Cl+Br2 | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均为水作还原剂的氧化还原反应 |