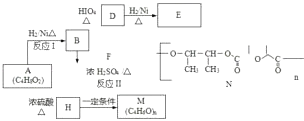
题目内容
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
一种工业合成氨的简易流程图如下: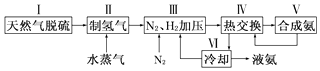
(1)在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 . 升高平衡体系的温度(保持体积不变),该反应(填“逆向移动”正向移动”或“不移动”).
(2)氨水、氯水中均存在多种微粒和多个平衡,请写出氯水中存在的一个化学平衡反应的离子方程式 .
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.4kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 .
a.升高温度 b.增大压强 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量.若2mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到2.28mol CO、CO2和H2的混合气体,则CO转化率为
【答案】
(1)1:3;逆向移动
(2)Cl2+H2O?H++Cl﹣+HClO
(3)a;70%
【解析】解:(1)依据起始量氮气和氢气物质的量之比等于反应之比分析判断,在密闭容器中,使2molN2和6molH2混合发生反应,应物起始量之比等于化学方程式中的反应之比,所以平衡浓度为1:3;合成氨的反应为放热反应,升高温度,平衡向吸热方向移动,即逆方向,
所以答案是:1:3; 逆向移动;(2)氯水是氯气与水的混合液,其中氯气与水反应生成盐酸和次氯酸,该反应是可逆反应,离子反应为Cl2+H2OH++Cl﹣+HClO,
所以答案是:Cl2+H2OH++Cl﹣+HClO;(3)反应①是个体积增大的吸热反应,升高温度,反应速率加快,反应正向移动,氢气含量增多,a正确,增大压强平衡逆向移动,氢气含量降低,b错误,催化剂加快反应速率,但平衡不移动,c错误,降低压强,反应速率减慢,d错误,选a;
2mol CO和H2的混合气体(H2的体积分数为80%)中 H2为:2mol×80%=1.6mol,CO的物质的量为:0.4mol,与H2O反应,得到2.28mol CO、CO2和H2的混合气体,该反应前后气体体积不变,增加的部分应该是起始的水蒸气的物质的量为:2.28mol﹣2mol=0.28mol,设转化的一氧化碳的物质的量为x,则
CO(g) | + | H2O(g) | CO2(g) | + | H2(g) | ||
起始量(mol) | 0.4 | 0.28 | 0 | 1.6 | |||
变化量(mol) | x | x | x | x | |||
平衡量(mol) | 0.4﹣x | 0.28﹣x | x | x+1.6 |
则:0.4﹣x+x+x+1.6=2.28,
x=0.28mol
则CO转化率为:0.28mol/0.4mol×100%=70%,
所以答案是:a;70%.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

【题目】下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )
选项 | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A.A
B.B
C.C
D.D