题目内容
【题目】如图所示,p、q、m、n分别为常见的气体单质,p和s均为有色气体,q能在p中燃烧并产生苍白色火焰,v的水溶液呈碱性,t的水溶液呈酸性。回答下列问题:
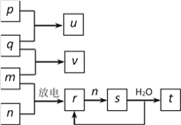
(1)新制p的水溶液中,除H2O、H+、OH-外,还含有____________等粒子(填化学式)
(2)取2份新制p的水溶液,向第一份中滴入紫色石蕊溶液,现象是____________;第二份先滴入FeCl2溶液,后加入KSCN溶液,其现象是_____________,有关反应的离子方程式为_______________、_________________。
(3)反应“v+n→r”的化学方程式是__________,每转移2 mol电子,可生成标准状况下的r气体________L。s溶于水的反应中,氧化剂与还原剂的物质的量之比为________
【答案】 Cl2、HClO、Cl-、ClO- 溶液先变红后褪色 溶液变红 2Fe2++Cl2==2Fe3++2Cl- Fe3++3SCN-==Fe(SCN)3 4NH3+5O2![]() 4NO+6H2O 8.96L 1∶2
4NO+6H2O 8.96L 1∶2
【解析】(1)q能在p中燃烧并产生苍白色火焰,则q为氢气,p为氯气。新制p的水溶液中,发生反应的离子方程式是:Cl2+H2O==H++Cl-+HClO,除H2O、H+、OH-外,溶液中还含有HClO、Cl-、HClO-,及溶解的Cl2等粒子;(2)紫色石蕊溶液加入酸中呈红色,后由于HClO的漂白性而褪色,故实验现象是溶液先变红后褪色;Fe2+会被氧化为Fe3+,加入KSCN溶液后溶液变红,发生了如下反应:2Fe2++Cl2==2Fe3++2Cl-,Fe3++3SCN-==Fe(SCN)3;(3)v的水溶液呈碱性,q为氢气,可知v为氨气,m为氮气,m与n在放电作用下生成r,又与n反应生成有色气体s,可知n为氧气,r为NO,s为NO2,v+n→r的化学方程式是:4NH3+5O2![]() 4NO+6H2O,生成4molNO需要转移电子20mol,则转移2mol电子生成2/5molNO,其体积为8.96L;NO2溶于水的反应为:3NO2+H2O=2HNO3+NO,NO2既为氧化剂又为还原剂,还原产物为NO,氧化产物为HNO3,则发生反应的氧化剂与还原剂的物质的量之比为1:2。
4NO+6H2O,生成4molNO需要转移电子20mol,则转移2mol电子生成2/5molNO,其体积为8.96L;NO2溶于水的反应为:3NO2+H2O=2HNO3+NO,NO2既为氧化剂又为还原剂,还原产物为NO,氧化产物为HNO3,则发生反应的氧化剂与还原剂的物质的量之比为1:2。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题:
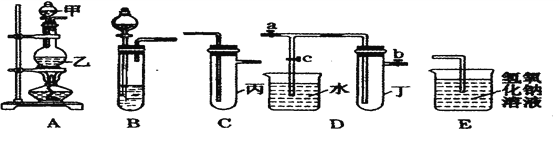
(1)将A、C、E相连后,以浓盐酸和_______(填写名称)为原料制取Cl2,仪器乙的名称是________。写出实验中制备氯气的离子方程式___________________。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验实验操作、现象、结论如下:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将所得氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 向所得氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅰ获得结论是否合理?_________(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):___________________________________________。
实验Ⅱ获得结论是否合理?_________(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):______________________________________________。
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱。则C中预期出现的现象是______________________________________________________________。
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2。一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先______________________________,再____________________________以使烧杯中的水进入试管丁,观察现象。